| 盖斯定律 题目答案及解析
稿件来源:高途
| 盖斯定律题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
盖斯定律
化学反应都伴随着能量的变化,请根据有关知识回答下列问题:
下列反应中属于吸热反应的是 $\rm ($填“序号”$\rm )$。
①物质燃烧 ②炸药爆炸 ③酸碱中和反应 ④二氧化碳通过炽热的碳 ⑤食物因氧化而腐败 ⑥$\rm Ba(OH)_{2}·8H_{2}O$与$\rm NH_{4}Cl$反应 ⑦铁粉与稀盐酸反应
④⑥
"]]①物质燃烧、②炸药爆炸、③酸碱中和反应、⑤食物因氧化而腐败、⑦铁粉与稀盐酸反应属于放热反应,属于吸热反应的是④二氧化碳通过炽热的碳、⑥$\rm Ba(OH)_{2}·8H_{2}O$与$\rm NH_{4}Cl$反应;
如图所示装置可以说明有化学能转化为电能的实验现象为 ,正极的电极反应为 。
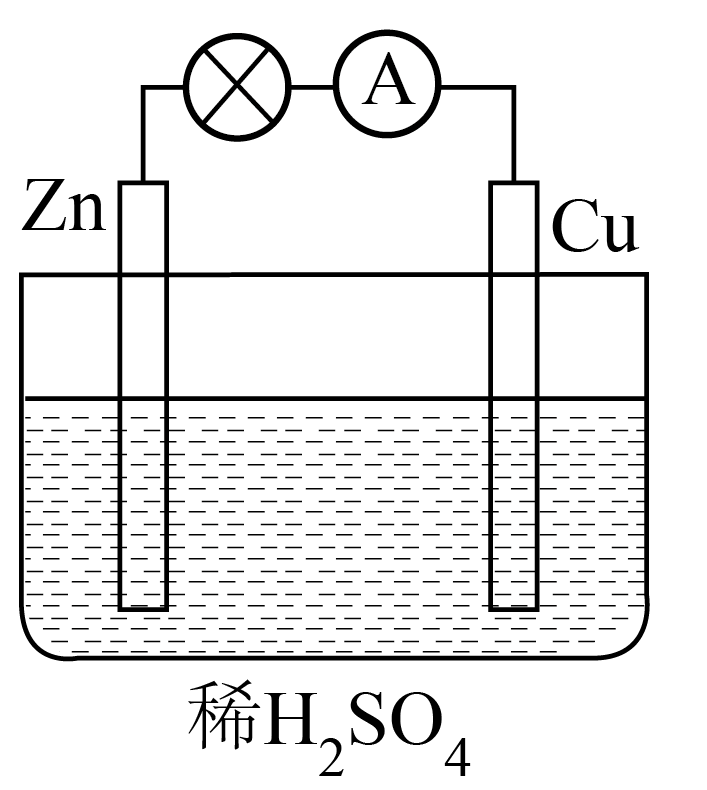
$\\rm Zn$片溶解、$\\rm Cu$片上有气泡生成、灯泡变亮 ; $\\rm 2H^{+}$ $\\rm +$ $\\rm 2e^{-}$ $\\rm =$ $\\rm H_{2}$ $\\rm ↑$
"]]如图所示装置可以构成原电池,原电池工作时,$\rm Zn$作负极,$\rm Cu$作正极,$\rm Zn$失电子生成$\rm Zn^{2+}$,溶液中的$\rm H^{+}$在$\rm Cu$电极得电子生成$\rm H_{2}$,线路中有电子从$\rm Zn$极移向$\rm Cu$极,灯泡发光,则说明有化学能转化为电能的实验现象为:$\rm Zn$片溶解、$\rm Cu$片上有气泡生成、灯泡变亮,正极的电极反应为$\rm 2H^{+}$ $\rm +$ $\rm 2e^{-}$ $\rm =$ $\rm H_{2}$ $\rm ↑$;
已知:$\rm 2$ $\rm mol$氢气与足量氧气充分燃烧生成液态水时放出$\rm 572$ $\rm kJ$热量。
①表示$\rm H_{2}$燃烧热的热化学方程式为:
②若$\rm H-H$键、$\rm O=O$键和$\rm H-O$键的键能分别为${{E}_{1}}$、${{E}_{2}}$和${{E}_{3}}$,反应$\text{2}{{\text{H}}_{\text{2}}}\left( \text{g} \right)+{{\text{O}}_{\text{2}}}\left( \text{g} \right)=2{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta H$,则$\Delta H=$ $\rm ($用含${{E}_{1}}$、${{E}_{2}}$、${{E}_{3}}$的式子表示$\rm )$,且$\Delta H$ $\rm ($填“大于”“小于”或“等于”$\rm )-572$ $\rm kJ/mol$。
${{\\text{H}}_{\\text{2}}}\\left( \\text{g} \\right)+\\dfrac{1}{2}{{\\text{O}}_{\\text{2}}}\\left( \\text{g} \\right)={{\\text{H}}_{\\text{2}}}\\text{O}\\left( \\text{l} \\right)\\quad \\Delta H=-286\\,\\text{kJ}\\cdot \\text{mo}{{\\text{l}}^{\\text{-1}}}$ ; $2{{E}_{1}}+{{E}_{2}}-4{{E}_{3}}$ ; 大于
"]]①$\rm 2$ $\rm mol$氢气与足量氧气充分燃烧生成液态水时放出$\rm 572$ $\rm kJ$热量,则表示$\rm H_{2}$燃烧热的热化学方程式为:${{\text{H}}_{\text{2}}}\left( \text{g} \right)+\dfrac{1}{2}{{\text{O}}_{\text{2}}}\left( \text{g} \right)={{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\quad \Delta H=-286\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$;
②若$\rm H-H$键、$\rm O=O$键和$\rm H-O$键的键能分别为$\rm E_{1}$、$\rm E_{2}$和$\rm E_{3}$,反应$2{{\text{H}}_{\text{2}}}\left( \text{g} \right)+{{\text{O}}_{\text{2}}}\left( \text{g} \right)=2{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta H$,则$\Delta H={{E}_{反应物}}()-{{E}_{生成物}}()=2{{E}_{1}}+{{E}_{2}}-4{{E}_{3}}$,$\rm H_{2}O(g)$转化为$\rm H_{2}O(l)$时,会放出热量,则$\Delta H$大于$\rm -572\;\rm kJ/mol$;
$\rm FeS_{2}$焙烧产生的$\rm SO_{2}$可用于制硫酸。
已知$\rm 25^\circ C$、$\rm 101$ $\rm kPa$时, $\text{2S}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+{{\text{O}}_{\text{2}}}\left( \text{g} \right)\overset{催化剂}{\underset{加热}{\rightleftharpoons}}2\text{S}{{\text{O}}_{\text{3}}}\left( \text{g} \right)\quad \Delta {{H}_{1}}=-197\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
${{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)={{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\quad \Delta {{H}_{2}}=-44\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$;
$\text{2S}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+{{\text{O}}_{\text{2}}}\left( \text{g} \right)+\text{2}{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)=2{{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}\left( \text{l} \right)\quad \Delta {{H}_{3}}=-545\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$;
则$\rm SO_{3}(g)$与$\rm H_{2}O(l)$反应生成$\rm H_{2}SO_{4}(l)$的热化学方程式是 。
$\\text{S}{{\\text{O}}_{\\text{3}}}\\left( \\text{g} \\right)+{{\\text{H}}_{\\text{2}}}\\text{O}\\left( \\text{l} \\right)={{\\text{H}}_{\\text{2}}}\\text{S}{{\\text{O}}_{\\text{4}}}\\left( \\text{l} \\right)\\quad \\Delta H=-130\\text{ kJ}\\cdot \\text{mo}{{\\text{l}}^{\\text{-1}}}$
"]]已知$\rm 25^\circ C$、$\rm 101$ $\rm kPa$时:
$\text{2S}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+{{\text{O}}_{\text{2}}}\left( \text{g} \right)2\overset{催化剂}{\underset{加热}{\rightleftharpoons}}\text{S}{{\text{O}}_{\text{3}}}\left( \text{g} \right)\quad \Delta {{H}_{1}}=-197\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$①
${{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)={{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\quad \Delta {{H}_{2}}=-44\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$ ②
$\text{2S}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+{{\text{O}}_{\text{2}}}\left( \text{g} \right)+\text{2}{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)=2{{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}\left( \text{l} \right)\quad \Delta {{H}_{3}}=-545\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$ ③
利用盖斯定律,将反应$\rm [$③$\rm -$①$\rm -$②$\rm \times 2]\div 2$得,$\rm SO_{3}(g)$与$\rm H_{2}O(l)$反应生成$\rm H_{2}SO_{4}(l)$的热化学方程式是$\text{S}{{\text{O}}_{\text{3}}}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)={{\text{H}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}\left( \text{l} \right)\quad \Delta H=\dfrac{-545\,\text{kJ/mol+197}\,\text{kJ/mol+44}\,\text{kJ/mol}\times \text{2}}{2}=-130\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$。
完全燃烧一定质量的无水乙醇,放出的热量为$a$,已知为了完全吸收生成的二氧化碳,消耗$\rm 50$ $\rm mL$ $\rm 8\;\rm mol/L$的氢氧化钠溶液,则$\rm 1$ $\rm mol$无水乙醇燃烧放出的热量$Q$可能是
$ a\le \text{ }Q\le $ $ a$
$5a\\text{ }\\le Q\\text{ }\\le 10a$
"]]完全燃烧一定质量的无水乙醇,放出的热量为$ a$,完全吸收生成的二氧化碳,消耗$\rm 50$ $\rm mL$ $\rm 8$ $\rm mol/L$的氢氧化钠溶液,若发生反应$\rm CO_{2}+2NaOH=Na_{2}CO_{3}+H_{2}O$,则生成$\rm CO_{2}$的物质的量为$\rm 0.2$ $\rm mol$,若发生反应$\rm CO_{2}+NaOH=NaHCO_{3}$,则生成$\rm CO_{2}$的物质的量为$\rm 0.4$ $\rm mol$,则$\rm 1$ $\rm mol$无水乙醇燃烧放出的热量$\rm Q$可能是$5a\text{ }\le Q\text{ }\le 10a$。
| 盖斯定律题目答案及解析(完整版)
