| 盖斯定律 题目答案及解析
稿件来源:高途
| 盖斯定律题目答案及解析如下,仅供参考!
选修四
第一章 化学反应与能量
第三节 化学反应热的计算
盖斯定律
$\rm CH_{4}/CO_{2}$催化重整的反应为
①$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)+\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons 2\text{CO}\left( \text{g} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)\qquad\Delta{{H}_{1}}$
其中,积炭是导致催化剂失活的主要原因。产生积炭的反应有:
②$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)\rightleftharpoons \text{C}\left( \text{s} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)\qquad\Delta{{H}_{2}}=+74.6\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
③$2\text{CO}\left( \text{g} \right)\rightleftharpoons \text{C}\left( \text{s} \right)+\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\qquad\Delta{{H}_{3}}=-172.5\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
科研人员研究压强对催化剂活性的影响:在$\rm 1073\;K$时,将恒定组成的$\rm CO_{2}$、$\rm CH_{4}$混合气体,以恒定流速通过反应器,测得数据如下。
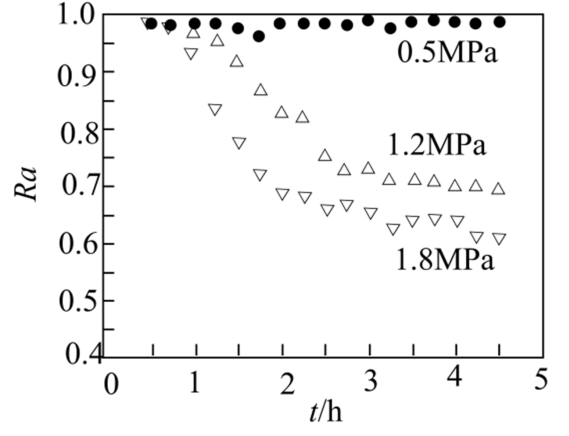
| 注$\rm :Ra$是以$\rm CH$的转化率表示的催化剂活性保留分率,即反应进行到某一时刻的催化剂活性与反应初始催化剂活性之比 |
下列分析不正确的是$(\qquad)$
$\\Delta H_{1}= +247.1\\;\\rm kJ·mol$
","保持其他条件不变,适当增大投料时$\\dfrac{n\\left( \\text{C}{{\\text{O}}_{2}} \\right)}{n\\left( \\text{C}{{\\text{H}}_{4}} \\right)}$,可减缓$\\rm Ra$的衰减
","研究表明“通入适量$\\rm O_{2}$有利于重整反应”,因为$\\rm O_{2}$能与$\\rm C$反应并放出热量
","压强越大,$\\rm Ra$降低越快,其主要原因是反应①平衡逆向移动
"]$\rm A$.根据盖斯定律,①$\rm =$②$\rm -$③,$\Delta H_{1}=\Delta H_{2}-\Delta H_{3}=+247.1\;\rm kJ\cdot mol^{-1}$,$\rm A$正确;
$\rm B$.保持其他条件不变,适当增大投料时$\dfrac{ {n}\left( \text{C}{{\text{O}}_{\text{2}}} \right)}{ {n}\left( \text{C}{{\text{H}}_{\text{4}}} \right)}$,增大$\rm CO_{2}$浓度,使反应③平衡逆向移动,减少积碳,可减缓$\rm Ra$的衰减,$\rm B$正确;
$\rm C$.根据盖斯定律,①$\rm =$②$\rm -$③,$\Delta H_{1}=\Delta H_{2}-\Delta H_{3}=+247.1\;\rm kJ\cdot mol^{-1}$,反应①为吸热反应,通入适量$\rm O_{2}$,$\rm O_{2}$能与$\rm C$反应并放出大量的热,可减少积碳减缓$\rm Ra$的衰减,同时反应放热使得反应①正向移动,有利于重整反应,$\rm C$正确;
$\rm D$.压强越大,$\rm Ra$降低越快,说明催化剂活性降低越快,积碳越多,其主要原因是反应③为气体体积减小的反应,加压平衡正向移动,使得积碳增多,$\rm D$错误。
故选:$\rm D$
| 盖斯定律题目答案及解析(完整版)
