| 化学平衡常数 题目答案及解析
稿件来源:高途
| 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
氮是地球上含量丰富的一种元素,氮元素的单质及其化合物在工农业生产生活中有着重要作用。
根据能量变化示意图,写出$\rm NO_{2}$和$\rm CO$反应的热化学方程式 。
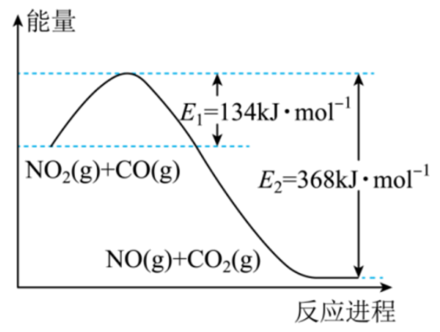
$\\text{N}{{\\text{O}}_{\\text{2}}}\\left( \\text{g} \\right)+\\text{CO}\\left( \\text{g} \\right)=\\text{NO}\\left( \\text{g} \\right)+\\text{C}{{\\text{O}}_{\\text{2}}}\\left( \\text{g} \\right)\\quad \\Delta H=-234\\,\\text{kJ}\\cdot \\text{mo}{{\\text{l}}^{\\text{-1}}}$
"]]根据能量变化示意图,$\rm NO_{2}$和$\rm CO$反应,$\Delta H=134\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}-368\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}=-234\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$,热化学方程式为$\text{N}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+\text{CO}\left( \text{g} \right)=\text{NO}\left( \text{g} \right)+\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\quad \Delta H=-234\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$。
用$\rm NH_{3}$催化还原$\text{N}{{\text{O}}_{x}}$还可以消除氮氧化物的污染。例如:
$4\text{N}{{\text{H}}_{\text{3}}}\left( \text{g} \right)+3{{\text{O}}_{\text{2}}}\left( \text{g} \right)=2{{\text{N}}_{\text{2}}}\left( \text{g} \right)+6{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{1}}=-a\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$①
${{\text{N}}_{\text{2}}}\left( \text{g} \right)+{{\text{O}}_{\text{2}}}\left( \text{g} \right)2\text{NO}\left( \text{g} \right)\quad \Delta {{H}_{2}}=-b\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$②
若$\rm 1$ $\rm mol$ $\rm NH_{3}$还原$\rm NO$至$\rm N_{2}$,则该反应过程中的反应热$\Delta {{H}_{3}}=$ $\rm kJ/mol$ $\rm ($用含$a$、$b$的式子表示$\rm )$。
$\\dfrac{-a+3b}{4}$
"]]$4\text{N}{{\text{H}}_{\text{3}}}\left( \text{g} \right)+3{{\text{O}}_{\text{2}}}\left( \text{g} \right)=2{{\text{N}}_{\text{2}}}\left( \text{g} \right)+6{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{1}}=-a\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$①
${{\text{N}}_{\text{2}}}\left( \text{g} \right)+{{\text{O}}_{\text{2}}}\left( \text{g} \right)2\text{NO}\left( \text{g} \right)\quad \Delta {{H}_{2}}=-b\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$ ②
利用盖斯定律,将反应$\rm [$①$\rm -$②$\rm \times 3]\div 4$得,$\rm 1$ $\rm mol$ $\rm NH_{3}$还原$\rm NO$至$\rm N_{2}$反应过程中的反应热 $\Delta {{H}_{3}}=\dfrac{-a+3b}{4}\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$。
在固定体积的密闭容器中,进行如下化学反应: ${{\text{N}}_{\text{2}}}\left( \text{g} \right)+3{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{2N}{{\text{H}}_{\text{3}}}\left( \text{g} \right)\quad \Delta H\lt 0$,
①该反应的平衡常数表达式:$K=$
②一定温度下,在$\rm 2$ $\rm L$密闭容器中充入$\rm 1\;\rm mol$ $\rm N_{2}$和$\rm 3$ $\rm mol$ $\rm H_{2}$并发生反应。若容器容积恒定,$\rm 10$ $\rm min$达到平衡时,气体的总物质的量为原来的$\dfrac{7}{8}$,则$\rm N_{2}$的转化率$\rm \alpha(N_{2})$ $\rm =$ ,以$\rm NH_{3}$ 表示该过程的反应速率$v\left( \text{N}{{\text{H}}_{\text{3}}} \right)=$ 。
③下列选项不能证明合成氨反应达到化学平衡状态的是 。
$\rm A$. $\rm N_{2}$、$\rm H_{2}$和$\rm NH_{3}$的浓度不再变化
$\rm B$. 单位时间内消耗$n\text{ mol }{{\text{N}}_{2}}$同时消耗$3n\,\text{mol }{{\text{H}}_{2}}$
$\rm C$. $\rm 1$ $\rm mol$氮氮三键断裂同时$\rm 6$ $\rm mol$ N$\rm -$H键断裂
$\rm D$. 恒容时容器内总压强不随时间而变化
$\rm E$. 恒容时混合气体的密度保持不变
$\rm F$. 混合气体的平均相对分子质量不再改变
$\\dfrac{{{c}^{2}}(\\text{N}{{\\text{H}}_{3}})}{c({{\\text{N}}_{2}})\\cdot {{c}^{3}}({{\\text{H}}_{2}})}$ ; $\\rm 25\\%$ ; $\\rm 0.025$ $\\rm mol/(L·min)$ ; $\\rm BE$
"]]在固定体积的密闭容器中,进行如下化学反应: ${{\text{N}}_{\text{2}}}\left( \text{g} \right)+3{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons 2\text{N}{{\text{H}}_{\text{3}}}\left( \text{g} \right)\quad \Delta H\lt 0$,
①该反应的平衡常数表达式: $K=\dfrac{{{c}^{2}}(\text{N}{{\text{H}}_{3}})}{c({{\text{N}}_{2}})\cdot {{c}^{3}}({{\text{H}}_{2}})}$。
②一定温度下,在$\rm 2$ $\rm L$密闭容器中充入$\rm 1$ $\rm mol$ $\rm N_{2}$和$\rm 3$ $\rm mol$ $\rm H_{2}$并发生反应。若容器容积恒定,$\rm 10$ $\rm min$达到平衡时,设参加反应$\rm N_{2}$的物质的量为$x$,则可建立如下三段式:
$\begin{matrix} {} & {{\text{N}}_{2}}(\text{g}) & + & 3{{\text{H}}_{2}}(\text{g}) & \rightleftharpoons & \text{2N}{{\text{H}}_{3}}(\text{g}) \\起始量 (\text{mol}) & 1 & {} & 3 & {} & 0 \\变化量 (\text{mol}) & x & {} & 3x & {} & 2x \\平衡量 (\text{mol}) & 1-x & {} & 3-3x & {} & 2x \\ \end{matrix}$
$\dfrac{4-2x}{4}\rm =\dfrac{7}{8}$,$x=0.25\,\text{mol}$,则$\rm N_{2}$的转化率$\rm \alpha(N_{2})$ $\rm =\dfrac{0.25\;\rm \text{mol}}{1\;\rm \text{mol}}\times 100\%\rm =25\%$,以$\rm NH_{3}$表示该过程的反应速率$v\left( \text{N}{{\text{H}}_{3}} \right)=\dfrac{0.5\,\text{mol}}{2\,\text{L}\times 10\,\min }\rm =$ $\rm 0.025$ $\rm mol/(L·min)$。
③$\rm A$.$\rm N_{2}$、$\rm H_{2}$和$\rm NH_{3}$的浓度不再变化时,正逆反应速率相等,反应达平衡状态;
$\rm B$.单位时间内消耗$n\text{ mol }{{\text{N}}_{\text{2}}}$同时消耗$3n\,\text{mol }{{\text{H}}_{\text{2}}}$,反应进行的方向相同,不一定达平衡状态;
$\rm C$.$\rm 1$ $\rm mol$氮氮三键断裂同时$\rm 6$ $\rm mol$ $\rm N-H$键断裂,反应进行的方向相反,且变化量之比等于化学计量数之比,反应达平衡状态;
$\rm D$.反应前后气体分子数不相等,恒容时容器内总压强不随时间而变化,反应达平衡状态;
$\rm E$.混合气体的质量、体积始终不变,则恒容时混合气体的密度保持不变时,反应不一定达平衡状态;
$\rm F$.反应达平衡前,混合气体的质量不变、物质的量不断发生改变,则当平均相对分子质量不再改变时,反应达平衡状态;
综合以上分析,$\rm BE$符合题意。
对反应${{\text{N}}_{\text{2}}}{{\text{O}}_{\text{4}}}\left( \text{g} \right)\rightleftharpoons 2\text{N}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\quad \Delta H\gt 0$,在温度分别为${{T}_{1}}$、${{T}_{2}}$时,平衡体系中$\rm NO_{2}$的体积分数随压强变化曲线如图所示,下列说法正确的是 。
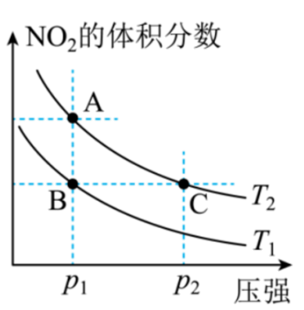
$\rm a$.$\rm A$、$\rm C$两点的反应速率:$\rm A\gt C$
$\rm b$.$\rm A$、$\rm C$两点的化学平衡常数:$\rm A\gt C$
$\rm c$.$\rm A$、$\rm C$两点$\rm N_{2}O_{4}$的转化率:$\rm A\gt C$
$\rm d$.由状态$\rm B$到状态$\rm A$,可以用降温的方法
$c$
"]]对反应${{\text{N}}_{\text{2}}}{{\text{O}}_{\text{4}}}\left( \text{g} \right)\rightleftharpoons 2\text{N}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\quad \Delta H\gt 0$,升高温度,平衡正向移动,$\rm NO_{2}$的体积分数增大,则${{T}_{1}}\lt {{T}_{2}}$。
$\rm a$.$\rm A$点压强小于$\rm C$点,则反应速率:$\rm A\lt C$,$\rm a$不正确;
$\rm b$.$\rm A$、$\rm C$两点的温度相同,化学平衡常数:$\rm A=C$,$\rm b$不正确;
$\rm c$.$\rm A$点压强小于$\rm C$点,加压平衡逆向移动,$\rm N_{2}O_{4}$的转化率减小,则$\rm A$、$\rm C$两点$\rm N_{2}O_{4}$的转化率:$\rm A\gt C$,$c$正确;
$\rm d$.${{T}_{1}}\lt {{T}_{2}}$,由状态$\rm B$到状态$\rm A$,可以用升温的方法,$\rm d$不正确;
| 化学平衡常数题目答案及解析(完整版)
