| 化学平衡常数 题目答案及解析
稿件来源:高途
| 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
平衡常数的计算:
下表是几种弱电解质的电离平衡常数$\rm (25\;\rm ^\circ\rm C)$
| 电解质 | 电离方程式 | 平衡常数$K$ |
| $\text{C}{{\text{H}}_{3}}\text{COOH}$ | $\text{C}{{\text{H}}_{3}}\text{COOH}\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{CO}{{\text{O}}^{-}}+{{\text{H}}^{+}}$ | $1.76\times {{10}^{-5}}$ |
| ${{\text{H}}_{2}}\text{C}{{\text{O}}_{3}}$ | ${{\text{H}}_{2}}\text{C}{{\text{O}}_{3}}\rightleftharpoons {{\text{H}}^{+}}+\text{HC}{\text{O}}_{3}^{-}$ $\text{HC}{\text{O}_{3}}^{-}\rightleftharpoons {{\text{H}}^{+}}+\text{C}\text{O}_{3}^{2-}$ | ${{K}_{1}}=4.31\times {{10}^{-7}}$${{K}_{2}}=5.61\times {{10}^{-11}}$ |
| $\text{HA}$ | $\text{HA}\rightleftharpoons {{\text{A}}^{-}}+{{\text{H}}^{+}}$ | $1.1\times {{10}^{-10}}$ |
| ${{\text{H}}_{3}}\text{P}{{\text{O}}_{4}}$ | $\rm{{\text{H}}_{3}}\text{P}{{\text{O}}_{4}}\rightleftharpoons {{\text{H}}^{+}}+{{\text{H}}_{2}}\text{P}{\text{O}}_{4}^{-}$${{\text{H}}_{2}}\text{P}{{\text{O}}_{4}}^{-}\rightleftharpoons {{\text{H}}^{+}}+\text{HP}{\text{O}}_{4}^{2-}$$ \text{HP}{\text{O}}_{4}^{2-}\rightleftharpoons {{\text{H}}^{+}}+\text{P}{\text{O}}_{4}^{3-}$ | ${{K}_{1}}=7.52\times {{10}^{-3}}$ ${{K}_{2}}=6.23\times {{10}^{-8}}$$ {{K}_{3}}=2.20\times {{10}^{-13}}$ |
| $\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O}$ | $\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O}\rightleftharpoons \text{NH}_{4}^{+}+\text{O}{{\text{H}}^{-}}$ | $1.76\times {{10}^{-5}}$ |
回答下列问题:
用$0.1000\,\text{mol}\cdot {{\text{L}}^{-1}}\,\text{NaOH}$溶液滴定$\rm 20.00$ $\rm mL$某未知浓度的一元酸$\rm HX$溶液,如图所示。其中①点所示溶液中$c({{\text{X}}^{-}})=2c(\text{HX})$,③点所示溶液中存在$c({{\text{X}}^{-}})+c(\text{HX})=c(\text{N}{{\text{a}}^{+}})$,则$\rm HX$的电离平衡常数${{K}_{\text{a}}}=$ 。
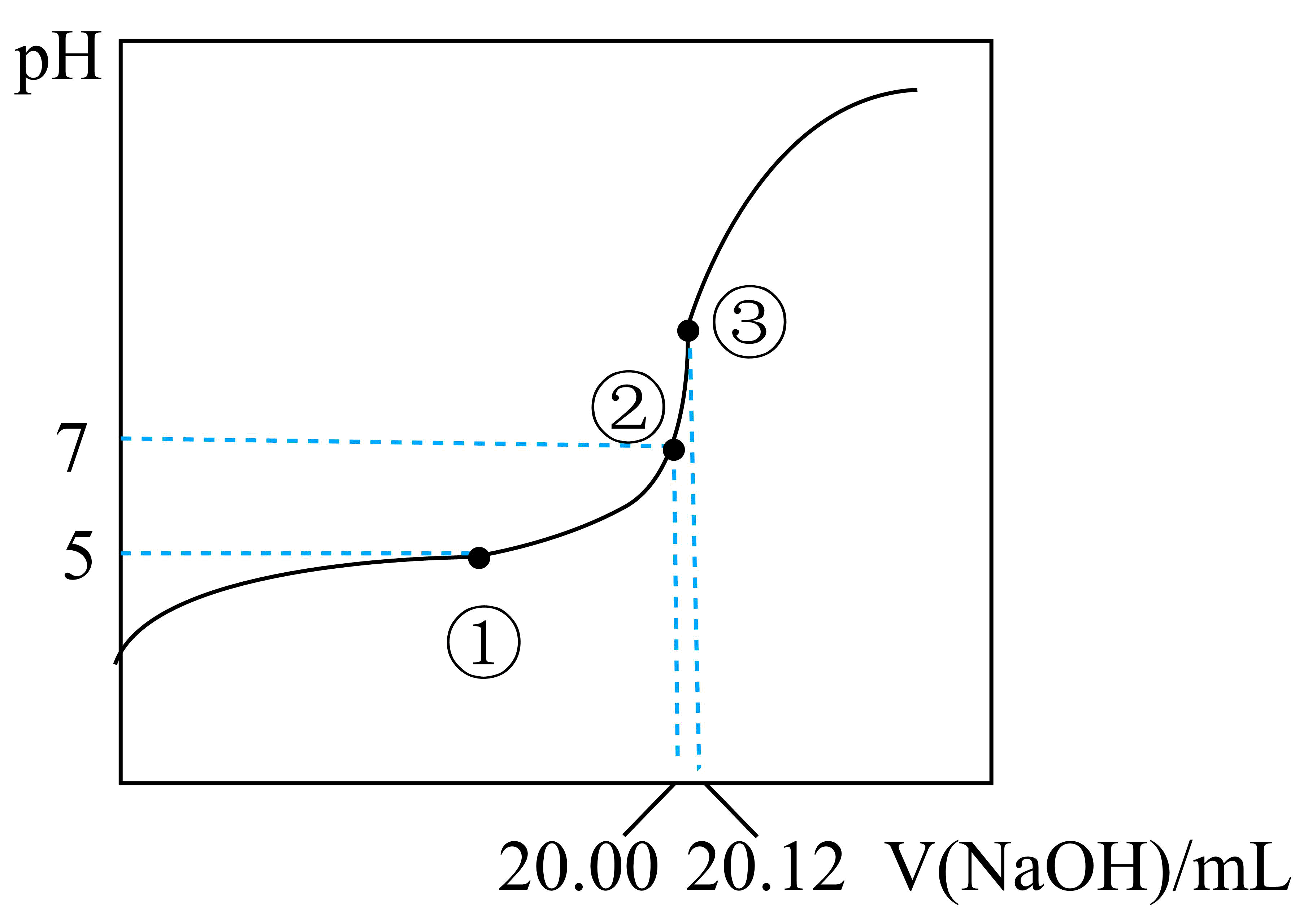
$2\\times {{10}^{-5}}$
"]]①点所示溶液的$\rm pH=5$,则氢离子浓度为:$c\left( {{\text{H}}^{+}} \right)=1\times {{10}^{-5}}\,\text{mol/L}$,且此时$c\left( \text{C}{{\text{H}}_{\text{3}}}\text{CO}{{\text{O}}^{-}} \right)=2c\left( \text{C}{{\text{H}}_{\text{3}}}\text{COOH} \right)$,所以$\rm CH_{3}COOH$的电离平衡常数为: ${{K}_{\text{a}}}=\dfrac{c\left( \text{C}{{\text{H}}_{\text{3}}}\text{CO}{{\text{O}}^{-}} \right)\cdot c\left( {{\text{H}}^{+}} \right)}{c\left( \text{C}{{\text{H}}_{\text{3}}}\text{COOH} \right)}\rm =2\times 10^{-5}$ $\rm mol/L$;
水解反应是典型的可逆反应。请写出$\rm Na_{2}CO_{3}$水解反应的离子方程式: 。
$\\text{CO}_{3}^{2-}+{{\\text{H}}_{2}}\\text{O}\\rightleftharpoons \\text{HCO}_{3}^{-}+\\text{O}{{\\text{H}}^{-}}$、$\\text{HCO}_{3}^{-}+{{\\text{H}}_{2}}\\text{O}\\rightleftharpoons {{\\text{H}}_{2}}\\text{C}{{\\text{O}}_{3}}+\\text{O}{{\\text{H}}^{-}}$
"]]多元弱酸的正盐水解是分步的,$\rm Na_{2}CO_{3}$水解反应的离子方程式为$\text{CO}_{3}^{2-}+{{\text{H}}_{2}}\text{O}\rightleftharpoons \text{HCO}_{3}^{-}+\text{O}{{\text{H}}^{-}}$、$\text{HCO}_{3}^{-}+{{\text{H}}_{2}}\text{O}\rightleftharpoons {{\text{H}}_{2}}\text{C}{{\text{O}}_{3}}+\text{O}{{\text{H}}^{-}}$;
水解反应的化学平衡常数称为水解常数$\rm ($用${{K}_{\text{h}}}$表示$\rm )$,类比化学平衡常数的定义,请写出$\rm Na_{2}CO_{3}$第一步水解反应的水解常数的表达式:${{K}_{\text{h}1}}=$ 。根据上表数据计算,$\rm 25\;\rm ^\circ\rm C$该常数的数值为 $\rm ($保留$\rm 2$位小数$\rm )$。
$\\dfrac{{{K}_{\\text{w}}}}{{{K}_{\\text{a}}}}$ ; $1.78\\times {{10}^{-4}}$
"]]$\rm Na_{2}CO_{3}$第一步水解反应的水解常数的表达式: ${{K}_{\text{h}1}}=\dfrac{c\left( \text{HCO}_{3}^{-} \right)\cdot c\left( \text{O}{{\text{H}}^{-}} \right)}{c\left( \text{CO}_{3}^{2-} \right)}=\dfrac{c\left( \text{HCO}_{3}^{-} \right)\cdot c\left( \text{O}{{\text{H}}^{-}} \right)\cdot c\left( {{\text{H}}^{+}} \right)}{c\left( \text{CO}_{3}^{2-} \right)\cdot c\left( {{\text{H}}^{+}} \right)}=\dfrac{{{K}_{\text{w}}}}{{{K}_{\text{a}}}}$;根据上表数据计算,$\rm 25\;\rm ^\circ\rm C$该常数的数值为${{K}_{\text{h1}}}=\dfrac{{{K}_{\text{w}}}}{{{K}_{\text{a2}}}}\rm =\dfrac{{{10}^{-14}}}{5.61\times {{10}^{-11}}}\,\text{mol/L}\rm =1.78\times {{10}^{-4}}$ $\rm mol/L$。
| 化学平衡常数题目答案及解析(完整版)
