| 转化率、产率 题目答案及解析
稿件来源:高途
| 转化率、产率题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
转化率、产率
合理的利用吸收工业产生的废气$\rm CO_{2}$可以减少污染,变废为宝。
Ⅰ$\rm .$用$\rm CO_{2}$可以生产燃料甲醇。
请写出甲醇的官能团名称 。甲醇分子中$\rm C$、$\rm H$、$\rm O$原子的原子半径由大到小的顺序为 。
羟基 ; $\\rm C\\gt O\\gt H$
"]]甲醇为$\rm CH_{3}OH$,官能团为$\rm -OH$,名称为羟基,同主族从上到下原子半径逐渐增大,同周期自左向右原子半径逐渐减小,甲醇分子中$\rm C$、$\rm H$、$\rm O$原子的原子半径由大到小的顺序为$\rm C\gt O\gt H$;
Ⅱ$\rm .$已知: $\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+\text{3}{{\text{H}}_{\text{2}}}\left( \text{g} \right){{\rightleftharpoons }_{ }}\text{C}{{\text{H}}_{\text{3}}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{l} \right)\quad \Delta H=49.0\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$;一定条件下,向体积固定为$\rm 1$ $\rm L$的密闭容器中充入$\rm 1$ $\rm mol$ $\rm CO_{2}$和$\rm 3$ $\rm mol$ $\rm H_{2}$ ,测得$\rm CO_{2}$和$\rm CH_{3}OH(g)$的浓度随时间变化曲线如下图所示。
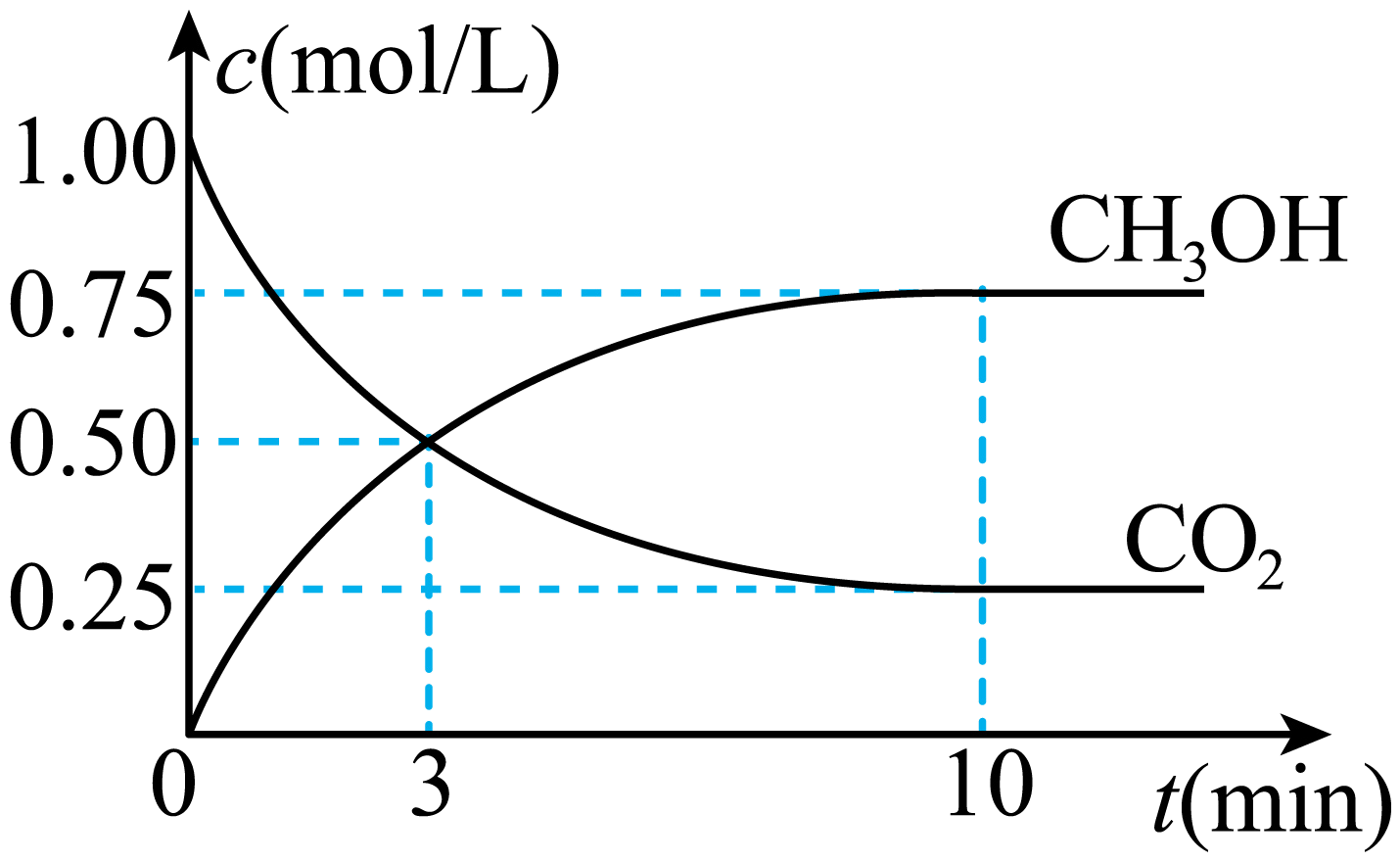
①反应开始至第$3$分钟时,反应速率$v\left( {{\text{H}}_{\text{2}}} \right)=$ $\rm \;\rm mol/(L·min)$。
②该条件下,$\rm CO_{2}$的平衡转化率是 ;
$\\rm 0.5$ ; $\\rm 75\\%$
"]]①反应进行到$\rm 3$ $\rm min$时,$\Delta C\left( \text{C}{{\text{O}}_{\text{2}}} \right)=\Delta C\left( \text{C}{{\text{H}}_{\text{3}}}\text{OH} \right)=0.5\,\text{mol/L}$,根据反应的方程式,则$\Delta C\left( {{\text{H}}_{2}} \right)=3\Delta C\left( \text{C}{{\text{O}}_{2}} \right)=1.5\,\text{mol/L}$,则$v\left( {{\text{H}}_{2}} \right)=1.5\,\text{mol/L}\div 3\,\text{min}=0.5\,\text{mol}/\left( \text{L}\cdot \text{min} \right)$;
②$\rm CO_{2}$的平衡转化率是$\dfrac{1.00-0.25}{1.00}\rm \times 100\%=75\%$;
Ⅲ$\rm .$用$\rm CO_{2}$合成二甲醚$\rm (CH_{3}OCH_{3})$。
① $\rm CO_{2}$ 催化加氢合成二甲醚的过程中主要发生下列反应:
反应$\rm I$: $\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{CO}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta H\text{ }=+41.2\text{ kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
反应$\rm II$: $2\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+6{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OC}{{\text{H}}_{\text{3}}}\left( \text{g} \right)+\text{3}{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta H=-122.5\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
其中,反应$\rm II$ 分以下$\rm a$、$\rm b$ 两步完成,请写出反应$\rm a$的热化学方程式。
$\rm a$.
$\rm b$. ${\rm 2\text{C}{{\text{H}}_{\text{3}}}\text{OH}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OC}{{\text{H}}_{\text{3}}}\left( \text{g} \right)+{{H}_{2}}O\left( g \right)}\quad \Delta H=-23.5\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$
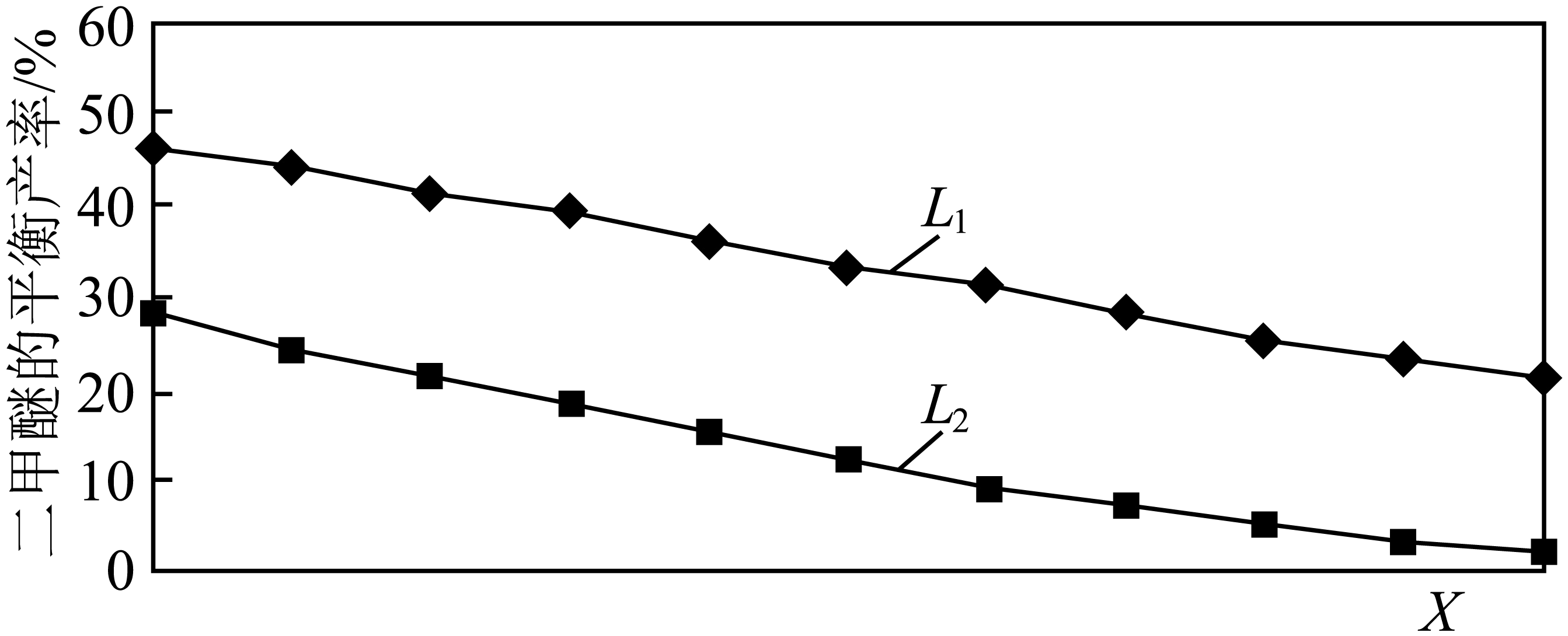
②$\rm L$ $\rm ({{L}_{1}}$、$\rm {{L}_{2}}\rm )$、$\rm X$分别代表压强或温度,下图表示$\rm L$一定时,反应$\rm II$中二甲醚的平衡产率随$\rm X$变化的关系,其中$\rm X$代表的物理量是 。判断$\rm {{L}_{1}}$、$\rm {{L}_{2}}$的大小,并简述理由: 。
③恒压时,在$\rm CO_{2}$和$\rm H_{2}$起始量一定的条件下,$\rm CO_{2}$平衡转化率和平衡时$\rm CH_{3}OCH_{3}$的选择性$\rm (CH_{3}OCH_{3}$的选择性$\rm =\dfrac{2\times \text{C}{{\text{H}}_{\text{3}}}\text{OC}{{\text{H}}_{\text{3}}}的物质的量}{反应的\text{C}{{\text{O}}_{2}的物质的量}}\times 100\%\rm )$随温度变化如下图所示。
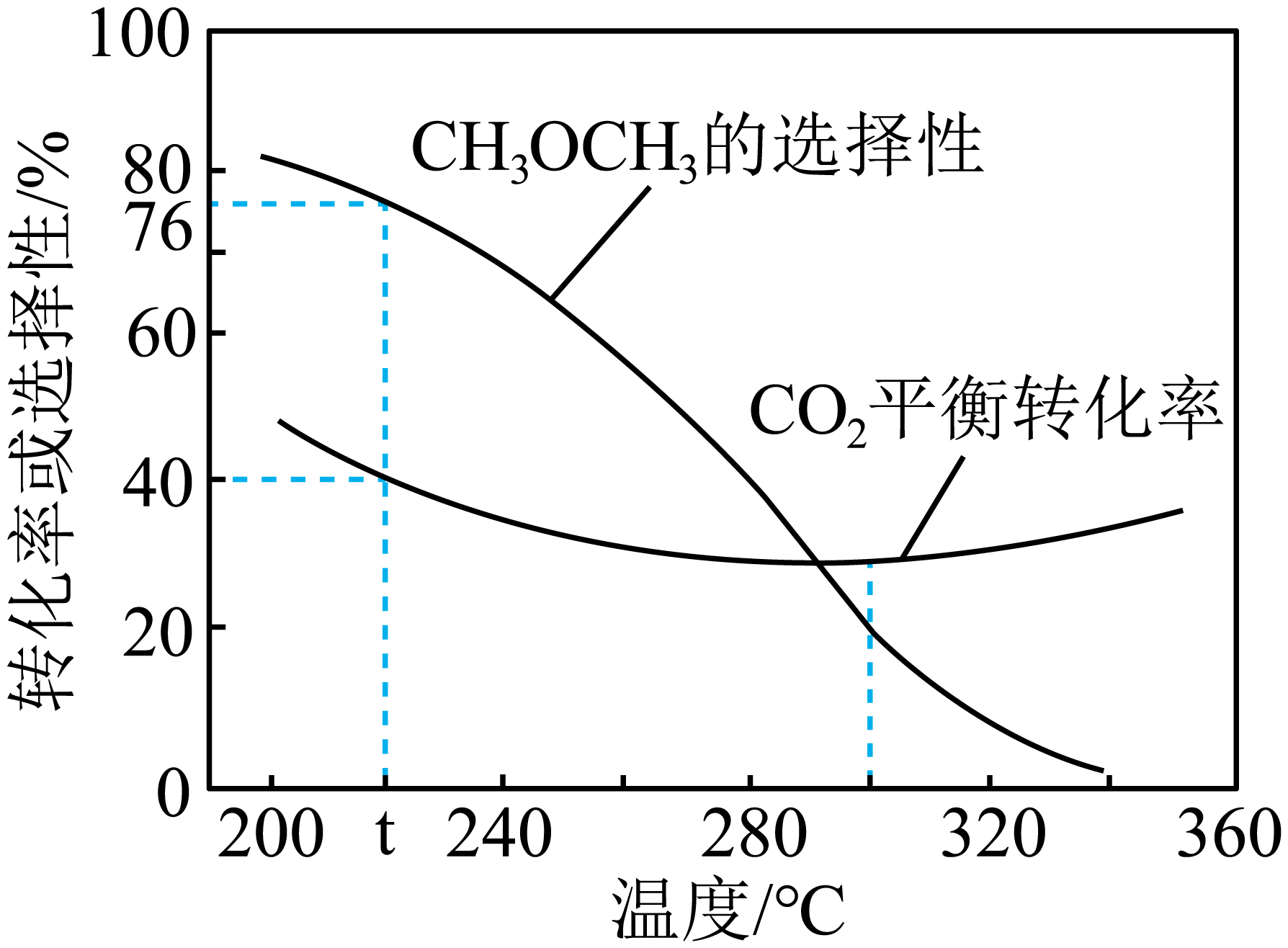
${\rm (i)}t\text{ }{}^\circ \text{C}$时,起始投入$a\text{ mol}\,\text{C}{{\text{O}}_{\text{2}}}$,$b\text{ mol }{{\text{H}}_{\text{2}}}$,达到平衡时反应Ⅱ消耗的$\rm H_{2}$的物质的量为 $\rm \;\rm mol$。$\rm ($列出计算式即可$\rm )$
$\rm (ii)$ 温度高于$\rm 300\;\rm ^\circ\rm C$,$\rm CO_{2}$平衡转化率随温度升高而增大的原因 。
$\\text{C}{{\\text{O}}_{\\text{2}}}\\left( \\text{g} \\right)+3{{\\text{H}}_{\\text{2}}}\\left( \\text{g} \\right)\\rightleftharpoons \\text{C}{{\\text{H}}_{\\text{3}}}\\text{OH}\\left( \\text{g} \\right)+\\text{ }{{\\text{H}}_{\\text{2}}}\\text{O}\\left( \\text{g} \\right)\\quad \\Delta H=-49.5\\text{ kJ}\\cdot \\text{mo}{{\\text{l}}^{\\text{-1}}}$ ; 温度 ; $\\rm {{L}_{1}}\\gt {{L}_{2}}$理由反应$\\rm II$是气体化学计量数减小的反应,当温度一定时,增大压强,平衡正向移动,二甲醚的平衡产率增大,与题图变化趋势相符 ; $\\rm 76\\%\\times 40\\%\\times 3a$ ; 反应$\\rm I$ 的$\\Delta H\\gt 0$,反应$\\rm II$的$\\Delta H\\lt 0$,温度升高使$\\rm CO_{2}$转化为$\\rm CO$的平衡转化率升高,使$\\rm CO_{2}$转化为$\\rm CH_{3}OCH_{3}$的平衡转化率下降,且增大的程度超过减小的程度
"]]①依据盖斯定律将方程式$\rm ($Ⅱ−$\rm b)/2$得方程式$a=\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+3{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta H=-49.5\,\text{kJ}\cdot \text{mo}{{\text{l}}^{\text{-1}}}$;
②该反应的正反应是放热反应,升高温度平衡逆向移动,则二甲醚的产率减小,该反应的正反应是一个反应前后气体体积减小的可逆反应,增大压强平衡正向移动,二甲醚的产率增大,根据图知,增大$\rm X$值曲线纵坐标减小,则改变的条件应该是升高温度,所以$\rm X$表示温度;由于反应$\rm II$是气体化学计量数减小的反应,当温度一定时,增大压强,平衡正向移动,二甲醚的平衡产率增大,与题图变化趋势相符,所以$\rm {{L}_{1}}\gt {{L}_{2}}$;
③ⅰ$\rm .$该温度下二甲醚的选择性是$\rm 76\%$,二氧化碳的转化率为$\rm 40\%$,则反应的$n\left( \text{C}{{\text{O}}_{\text{2}}} \right)=40\%\,a\,\text{mol}$,$\rm CH_{3}OCH_{3}$的选择性$\rm =2\times CH_{3}OCH_{3}$的物质的量$\rm /$反应的$\rm CO_{2}$的物质的量$ =\dfrac{2\times n\left( \text{C}{{\text{H}}_{\text{3}}}\text{OC}{{\text{H}}_{3}} \right)}{0.4a}\rm \times 100\%=76\%$,$n\left( \text{C}{{\text{H}}_{\text{3}}}\text{OC}{{\text{H}}_{\text{3}}} \right)=20\%a\times 76\%\,\text{mol}$,达到平衡时反应Ⅱ消耗的$n\left( {{\text{H}}_{\text{2}}} \right)=6n\left( \text{C}{{\text{H}}_{\text{3}}}\text{OC}{{\text{H}}_{\text{3}}} \right)=6\times 20\%a\times 76\%\,\text{mol}=3a\times 40\%\times 76\%\,\text{mol}$;
ⅱ$\rm .$由于反应$\rm I$的$\Delta H\gt 0$,反应$\rm II$的$\Delta H\lt 0$,温度升高使$\rm CO_{2}$转化为$\rm CO$的平衡转化率升高,使$\rm CO_{2}$转化为$\rm CH_{3}OCH_{3}$的平衡转化率下降,且增大的程度超过减小的程度,所以温度高于$\rm 300\;\rm ^\circ\rm C$,$\rm CO_{2}$平衡转化率随温度升高而增大。
| 转化率、产率题目答案及解析(完整版)
