| 化学平衡常数 题目答案及解析
稿件来源:高途
| 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
二氧化碳是用途非常广泛的化工基础原料,回答下列问题:
工业上可以用$\rm CO_{2}$来生产燃料甲醇。
已知:${\rm CO_{2}(g)+3H_{2}(g)= CH_{3}OH(l)+H_{2}O(l)}\qquad\Delta H=-a\;\rm kJ·mol^{-1}$
${\rm 2H_{2}(g)+O_{2}(g)=2H_{2}O(l)}\qquad\Delta H= -b\;\rm kJ·mol^{-1}$
$\rm CH_{3}OH(l)$的燃烧热$\Delta H=$ 。
$ -(\\dfrac{{3b}}{{2}}{-a}\\rm )\\;\\rm kJ\\cdot mol^{-1}$
"]]已知:①${\rm CO_{2}(g)+3H_{2}(g)=\rm CH_{3}OH(l)+H_{2}O(l)}\qquad \Delta H=-a\;\rm kJ·mol^{-1}$,②${\rm 2H_{2}(g)+O_{2}(g)=2H_{2}O(l)}\qquad\Delta H= -b\;\rm kJ·mol^{-1}$,根据盖斯定律,将②$\rm \times \dfrac{3}{2}\rm -$①得:$\rm {C}{{{H}}_{{3}}}{OH}\left( {l} \right)+\dfrac{3}{2}{{{O}}_{{2}}}\left( {g} \right){=C}{{{O}}_{{2}}}\left( {g} \right){+2}{{{H}}_{{2}}}{O}\left( {l} \right)$,即$ \Delta H=(-{b\;\rm kJ·mol^{-1}}\times \dfrac{3}{2} )-(-a{\;\rm kJ·mol^{-1}})=-(\dfrac{{3b}}{{2}}{-a} \rm )\;\rm kJ\cdot mol^{-1}$,故$\rm CH_{3}OH$的燃烧热为$ -(\dfrac{{3b}}{{2}}{-a}\rm )\;\rm kJ\cdot mol^{-1}$;
在催化剂作用下,$\rm CO_{2}$和$\rm CH_{4}$可直接转化为乙酸:${\rm CO_{2}(g)+CH_{4}(g) \rightleftharpoons CH_{3}COOH(g)}\qquad \Delta H\gt 0$在不同温度下乙酸的生成速率变化如下图:
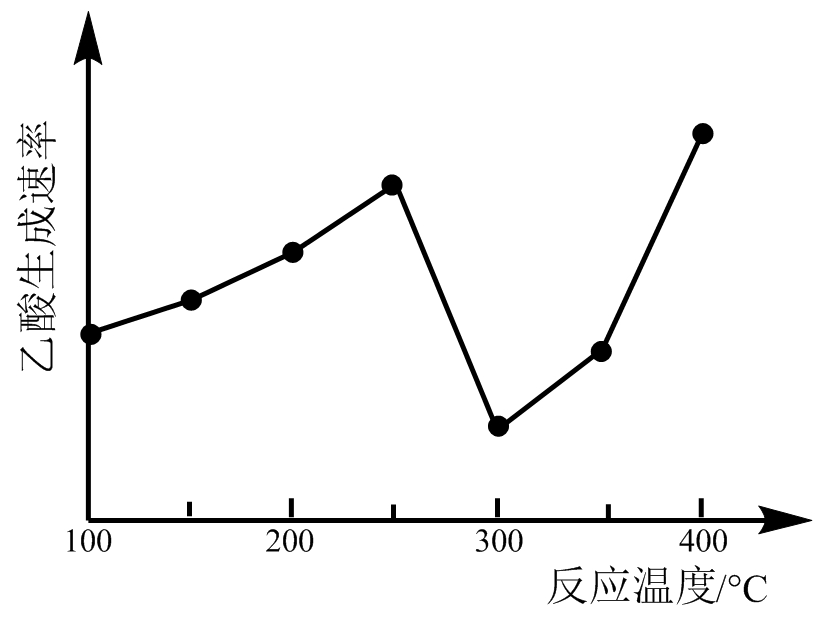
①当温度在$\rm 250\;\rm ^\circ\rm C-300\;\rm ^\circ\rm C$范围时,乙酸的生成速率减慢的原因是 。
②欲使乙酸的平衡产率提高,应采取的措施是 $\rm ($任写一条措施即可$\rm )$。
催化剂活性较低;增大压强或升高温度
"]]①催化剂的活性与温度有关,当温度在$\rm 250\;\rm ^\circ\rm C\sim 300\;\rm ^\circ\rm C$范围时,乙酸的生成速率减慢的主要原因是催化剂活性较低;
②欲使乙酸的平衡产率提高,应该使平衡正向移动,因为正反应为吸热反应,升高温度,平衡正向移动,乙酸的平衡产率提高;增大压强,平衡正向移动,乙酸的平衡产率提高;
一定条件下,在密闭恒容容器中发生反应:$\rm 2CO(g)\rightleftharpoons C(s)+CO_{2}(g)$。
①下列不能说明该反应达到平衡的是 。
$\rm A$. 容器内气体的总质量不变
$\rm B$. $\rm CO$和$\rm CO_{2}$的物质的量之比不再变化
$\rm C$. 混合气体的压强不再变化
$\rm D$. 单位时间内生成$\rm 1\;\rm mol$ $\rm CO$同时生成$\rm 2\;\rm mol$ $\rm CO_{2}$
$\rm E$. 混合气体的密度不变
$\rm F$. 反应的$\Delta H$不再改变
$\rm G$. $\rm CO$的转化率不再改变
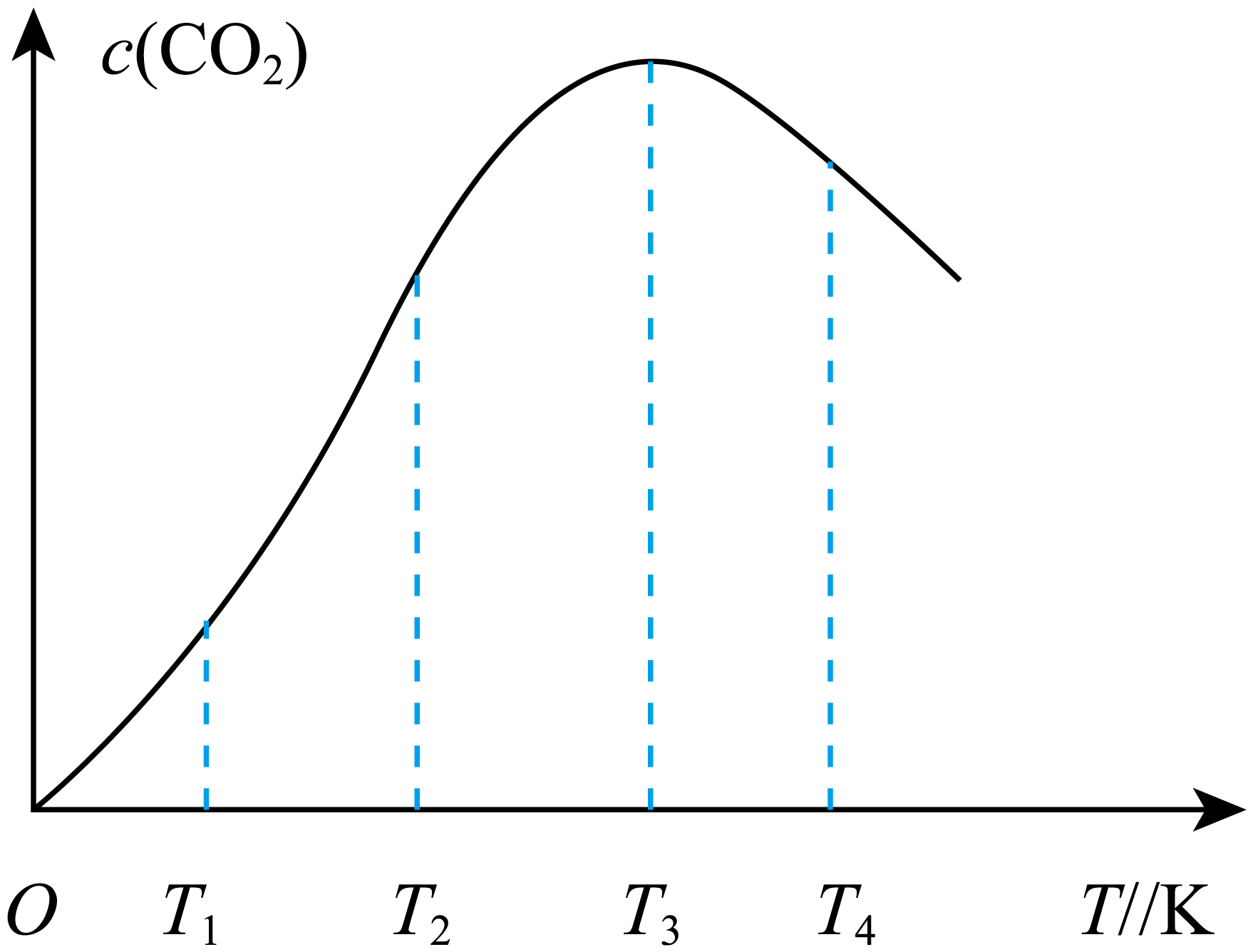
②向某恒容容器中通入一定量的$\rm CO$发生上述反应$\rm ($无催化剂$\rm )$,在不同温度下相同时间内产物$\rm CO_{2}$的物质的量浓度随温度的变化如下图所示,在$T_{3}$之前,随温度升高$c\rm (CO_{2})$逐渐升高的原因是 ,该反应为 $\rm ($填“放热”或“吸热”$\rm )$反应。
③向某密闭$\rm 2\;\rm L$恒容容器中通入一定量的 $\rm CO$,$T\;^\circ\rm C$时反应经过$\rm 5\;\rm min$后达到化学平衡,$\rm CO$的体积分数为$\rm 25\%$,则$\rm CO$的平衡转化率为 $\rm ($用分数表示$\rm )$,若实际通入$\rm CO$的物质的量为$\rm 1\;\rm mol$,则该温度下的平衡常数$K=$ 。
$\\rm DF$;升高温度,反应速率增大,所以相同时间内产物$\\rm C{{O}_{2}}$的物质的量浓度增大; 放热;$\\dfrac{6}{7}$;$\\rm 42$
"]]①$\rm A$.由$\rm \text{2CO}\left( \text{g} \right)\rightleftharpoons \text{C}\left( \text{s} \right)\text{+C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)$可知,该反应混合气体的总质量不断减小,当 容器内气体的总质量不变,说明该反应达到平衡状态,故$\rm A$不符合题意;
$\rm B$.$\rm CO$和$\rm CO_{2}$的物质的量之比不再变化,说明$\rm CO$和$\rm CO_{2}$的量不在改变,说明该反应达到平衡状态,故$\rm B$不符合题意;
$\rm C$.该反应为气体分子数减小的反应,随着反应进行,混合气体的压强不断减小,当混合气体的压强不再变化,说明该反应达到平衡状态,故$\rm C$不符合题意;
$\rm D$.单位时间内生成$\rm 1\;\rm mol\;\rm CO$同时生成$\rm 2\;\rm mol\;\rm CO_{2}$,不能说明正逆反应速率相等,反应不一定达到平衡状态,故$\rm D$符合题意;
$\rm E$.根据质量守恒,气体的总质量减小,容器体积不变,所以随着反应进行混合气体的密度减小,当混合气体的密度不变,说明反应达到平衡状态,故$\rm E$不符合题意;
$\rm F$.反应的$\Delta H$是定值,不能说明反应达到平衡状态,故$\rm F$符合题意;
$\rm G$.随着反应进行,$\rm CO$的转化率增大,当$\rm CO$的转化率不再改变,说明反应达到平衡状态,故$\rm G$不符合题意;
故答案为:$\rm DF$;
②在$T_{3}$之前,升高温度,反应速率增大,所以相同时间内产物$\rm CO_{2}$的物质的量浓度增大;$T_{3}$之后,升高温度,相同时间内产物$\rm CO_{2}$的物质的量浓度减小,说明平衡逆向移动,该反应为放热反应;
③设起始通入$\rm CO$物质的量为$\rm 1\;\rm mol$,列化学平衡三段式:$\begin{matrix} {} &\rm {2CO}\left( {g} \right) & \rightleftharpoons & \rm {C}\left( {s} \right) & + &\rm {C}{{{O}}_{{2}}}\left( {g} \right) \\起始量 (\rm {mol}) & 1 & {} & {} & {} & 0 \\变化量 (\rm {mol}) & 2{x} & {} & {} & {} & {x} \\ 平衡量(\rm {mol}) & 1-2{x} & {} & {} & {} & {x} \\ \end{matrix}$,$\rm CO$ 的体积分数为:$\dfrac{1-2{x}}{1-2{x}+{x}}\times 100\%=25\%$,解得$ x=\dfrac{3}{7}$,$\rm CO$的平衡转化率为:$\dfrac{\dfrac{3}{7}\times 2}{1}=\dfrac{6}{7}$;平衡时$n\rm (CO)=\dfrac{1}{7}$,$n\rm (CO_{2})=\dfrac{3}{7}$,则$c\rm (CO)=\dfrac{1}{14}$,$c\rm (CO_{2})=\dfrac{3}{14}$,平衡常数${K}=\dfrac{{c}\left(\rm {C}{{{O}}_{{2}}} \right)}{{{{c}}^{2}}\left(\rm {CO} \right)}=\dfrac{\dfrac{3}{14}}{{{(\dfrac{1}{14})}^{2}}}=42$。
| 化学平衡常数题目答案及解析(完整版)
