| 化学平衡常数 题目答案及解析
稿件来源:高途
| 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
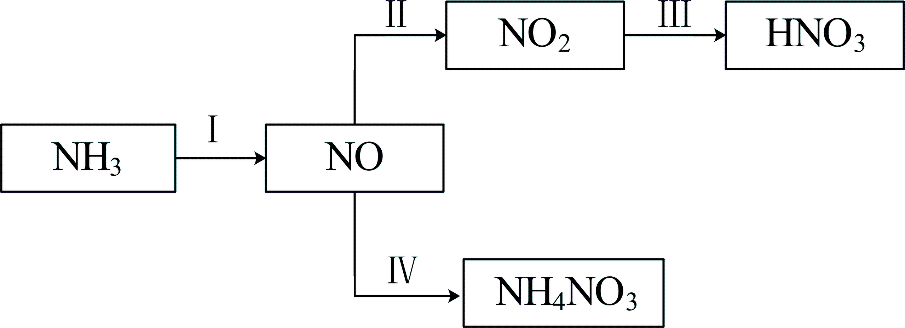
$\rm NH_{3}$经一系列反应可以得到$\rm HNO_{3}$和$\rm NH_{4}NO_{3}$,如下图所示。
$\rm II$中,$\rm 2NO(g) +O_{2}(g) \rightleftharpoons \rm 2NO_{2}(g)$ 。在其他条件相同时,分别测得$\rm NO$的平衡转化率在不同压强$(p_{1}$、$p_{2})$下温度变化的曲线$\rm ($如下图$\rm )$。
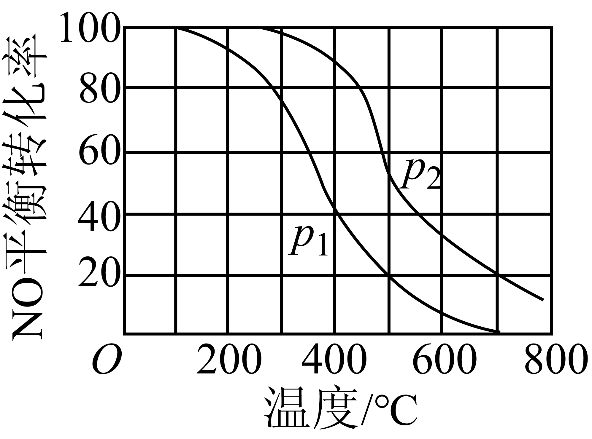
①比较$p_{1}$、$p_{2}$的大小关系并说明理由: 。
②随温度升高,该反应平衡常数变化的趋势是 $\rm ($增大、不变或减小$\rm )$。
该反应的正反应为气体物质的量减小的反应,其他条件不变时,增大压强,平衡向气体物质的量减小的方向移动,即向正反应方向移动,即压强越高,$\\rm NO$的平衡转化率越大,根据图示知,相同温度下,压强$P_{1}$时$\\rm NO$的转化率$\\lt P_{2}$时$\\rm NO$的转化率;减小
"]]①该反应的正反应为气体物质的量减小的反应,其他条件不变时,增大压强,平衡向气体物质的量减小的方向移动,即向正反应方向移动,即压强越高,$\rm NO$的平衡转化率越大,根据图示知,相同温度下,压强$P_{1}$时$\rm NO$的转化率$\lt P_{2}$时$\rm NO$的转化率,故$P_{1}\lt P_{2}$;
②其他条件不变时,升高温度,平衡向着吸热反应方向移动,又根据图示知,相同压强下,随着温度的升高,$\rm NO$的转化率降低,即升高温度,平衡向逆反应方向移动,故逆反应方向为吸热反应,则正反应方向是放热反应,则随着温度的升高,该反应的平衡常数减小。
$\rm III$中,将$\rm NO_{2}(g)$转化成$\rm N_{2}O_{4}(l)$,再制备浓硝酸。
①已知:
${\rm 2NO_{2}(g) \rightleftharpoons \rm N_{2}O_{4}(g)}\qquad \Delta H_{1}$
${\rm 2NO_{2}(g) \rightleftharpoons \rm N_{2}O_{4}(l)}\qquad \Delta H_{2}$
下列能量变化示意图中,正确的是$\rm ($选填字母$\rm )$ 。
$\rm A$.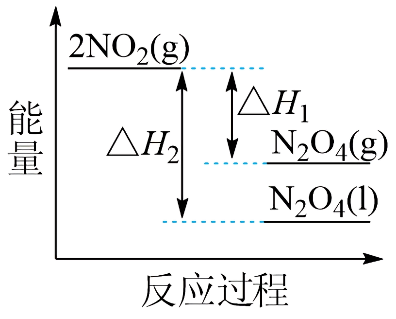 $\rm B$.
$\rm B$.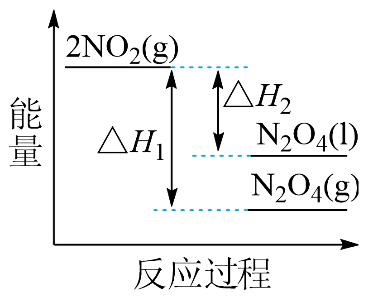 $\rm C$.
$\rm C$. 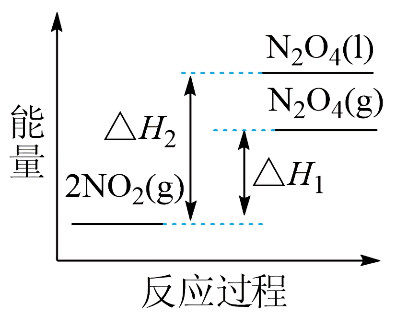
②反应:${\rm 2NO(g)+O_{2}(g)\rightleftharpoons \rm 2NO_{2}(g)}\qquad \Delta H={ -a\;\rm kJ/mol}(a\gt 0)$是制造硝酸的重要反应之一。在$\rm 800\;\rm ^\circ\rm C$时,向容积为$\rm 2\;\rm L$的密闭恒容容器中充入$\rm 0.010\;\rm mol\; NO$和$\rm 0.005\;\rm mol\; O_{2}$,反应过程中$\rm NO$的物质的量随时间变化如下图所示。
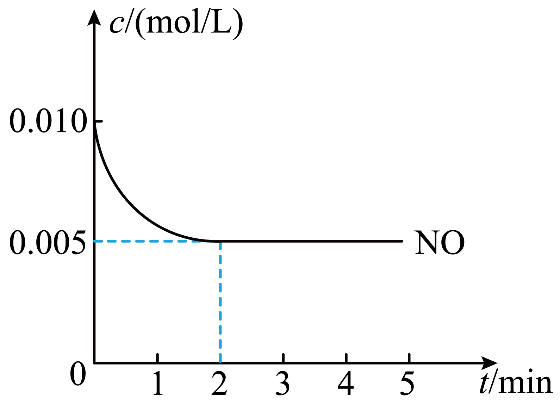
$\rm a$.$\rm 2\;\rm min$内,$v\rm (O_{2})=$ $\rm \;\rm mol/(L·min)$。
$\rm b$.$\rm 800\;\rm ^\circ\rm C$时,该反应的化学平衡常数的表达式为 。
$\rm c$.$\rm 800\;\rm ^\circ\rm C$时,若将容器体积压缩至$\rm 0.5\;\rm L$,该反应的化学平衡常数将 $\rm ($增大、不变或减小$\rm )$。
$\rm d$. $\rm 2\;\rm min$时,该反应放热 $\rm \;\rm kJ$。
$\\rm A$;$\\rm 6.25\\times 10^{-4}$;$\\dfrac{{{{c}}^{\\text{2}}}\\left( \\text{N}{{\\text{O}}_{\\text{2}}} \\right)}{{{{c}}^{\\text{2}}}\\left( \\text{NO} \\right){c}\\left( {{\\text{O}}_{\\text{2}}} \\right)}$;不变;$0.0025a$
"]]①根据盖斯定律:①$\rm -$②得${\rm N_{2}O_{4}(g)\rightleftharpoons \rm N_{2}O_{4}(l) }\qquad \Delta H_{3}=\Delta H_{1}-\Delta H_{2}$,一般来说,物质由气态变为液态,放出热量,即$\Delta H_{3}=\Delta H_{1}-\Delta H_{2}\lt 0$,即$\Delta H_{1}\gt \Delta H_{2}$,由降低温度,将$\rm NO_{2}$转化为$\rm N_{2}O_{4}$,可知该反应为放热反应,即$0\gt \Delta H_{1}\gt \Delta H_{2}$,即反应物$\rm 2NO_{2}(g)$的总能量大于生成物$\rm N_{2}O_{4}(g)$和$\rm N_{2}O_{4}(l)$的总能量,且前者放出的热量小,故答案为$\rm A$;
②$\rm a$.$\rm 2\;\rm min$内,${v\rm (O_{2})}=\dfrac{\text{1}}{\text{2}} v\rm (NO)=\dfrac{\text{1}}{\text{2}}\rm \times \dfrac{\text{0}\text{.01 mol-0}\text{.005 mol}}{\text{2\;\rm min}\times \text{2 L}}\rm =6.25\times 10^{-4}\;\rm mol/(L·min)$;
$\rm b$.$\rm 800\;\rm ^\circ\rm C$时,反应$\rm 2NO(g)+O_{2}(g)\rightleftharpoons \rm 2NO_{2}(g)$的化学平衡常数的表达式为$ K=\dfrac{{{{c}}^{\text{2}}}\left( \text{N}{{\text{O}}_{\text{2}}} \right)}{{{{c}}^{\text{2}}}\left( \text{NO} \right){c}\left( {{\text{O}}_{\text{2}}} \right)}$;
$\rm c$.化学平衡常数只受温度影响,$\rm 800\;\rm ^\circ\rm C$时,若将容器体积压缩至$\rm 0.5\;\rm L$,该反应的化学平衡常数将不变;
$\rm d$.$\rm 2\;\rm min$时,消耗$\rm 0.01\;\rm mol-0.005\;\rm mol=0.005\;\rm mol\;\rm NO$,由${\rm 2NO(g)+O_{2}(g)\rightleftharpoons \rm 2NO_{2}(g)}\qquad\Delta H= -a\;\rm kJ/mol$可知,每消耗$\rm 2\;\rm mol\;\rm NO$放出$a\;\rm kJ$能量,则消耗$\rm 0.005\;\rm mol\;\rm NO$,放出$\dfrac{ {a\;\rm kJ}}{\text{2}}\times \text{0}\text{.005} =0.0025a\;\rm kJ$能量。
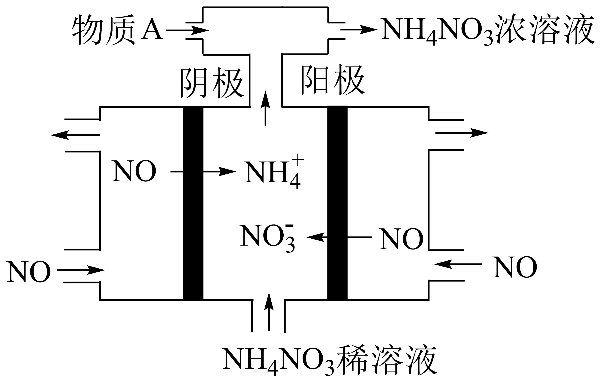
$\rm IV$中,电解$\rm NO$制备$\rm NH_{4}NO_{3}$,其工作原理如下图所示,已知电解池和原电池书写电极反应式的方法完全相同,阴极的电极反应式为$\rm NO$ $\rm +$ $\rm 5e^{-}$ $\rm +$ $\rm 6H^{+}$ $\rm =$ $\text{NH}_{\text{4}}^{+}\rm +$ $\rm H_{2}O$,则阳极的电极反应式为 ,为使电解产物全部转化为$\rm NH_{4}NO_{3}$,需补充物质$\rm A$,$\rm A$是 。
$\\rm NO-3e^{-}+2H_{2}O=\\text{NO}_{\\text{3}}^{-}\\rm +4H^{+}$;$\\rm NH_{3}$或$\\rm NH_{3}·H_{2}O$
"]]①电解$\rm NO$制备硝酸铵,$\rm NO$在阳极失去电子生成$\text{NO}_{\text{3}}^{-}$,根据得失电子守恒和电荷守恒配平电极方程式为:$\rm NO-3e^{-}+2H_{2}O=\text{NO}_{\text{3}}^{-}\rm +4H^{+}$;
②阴极反应为:$\rm NO\rm +\rm 5e^{-}\rm +\rm 6H^{+}\rm =\text{NH}_{\text{4}}^{+}\rm +\rm H_{2}O$,从两极反应可看出若要使电子得失守恒,阳极产生的$\text{NO}_{\text{3}}^{-}$的量大于阴极产生的$\text{NH}_{\text{4}}^{+}$的量,总反应为$\rm 8NO+7H_{2}O\begin{array}{*{20}{c}}{\underline{\underline {电解}} }\\{}\end{array} 3NH_{4}NO_{3}+2HNO_{3}$,因此若要使电解产物全部转化为$\rm NH_{4}NO_{3}$,故应补充适量的$\rm NH_{3}$或$\rm NH_{3}·H_{2}O$。
| 化学平衡常数题目答案及解析(完整版)
