高中 | 金属铁 题目答案及解析
稿件来源:高途
高中 | 金属铁题目答案及解析如下,仅供参考!
必修一
第三章 金属及其化合物
第一节 金属的化学性质
金属铁
纳米$\rm \text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}$在催化剂应用方面具有突出作用,化学学习小组进行$\rm \text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}$的相关实验。
实验一:由铁粉制备$\rm \text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}$。
利用如图装置制备$\rm \text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}$,试管中发生反应的化学方程式是 ,仪器$\rm a$的名称为 。
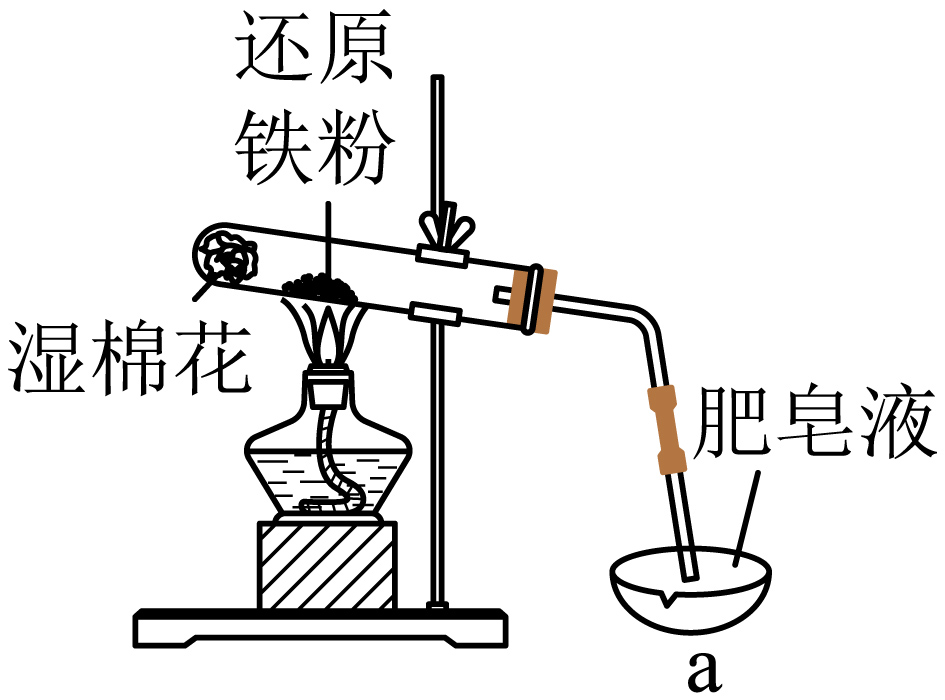
$\\rm 3\\text{Fe}+4{{\\text{H}}_{2}}\\text{O}\\left( \\text{g} \\right)\\begin{matrix} \\underline{\\underline{高温}} \\\\ {} \\\\ \\end{matrix}\\text{F}{{\\text{e}}_{3}}{{\\text{O}}_{4}}+4{{\\text{H}}_{2}}$;蒸发皿
"]]铁在高温下与水反应,生成四氧化三铁和氢气,反应方程式为:$\rm 3\text{Fe}+4{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\begin{matrix} \underline{\underline{高温}} \\ {} \\ \end{matrix}\text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}+4{{\text{H}}_{2}}$,仪器$\rm a$的名称为蒸发皿。
实验二:由铁泥按照如图甲实验流程制备$\text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}$纳米材料。
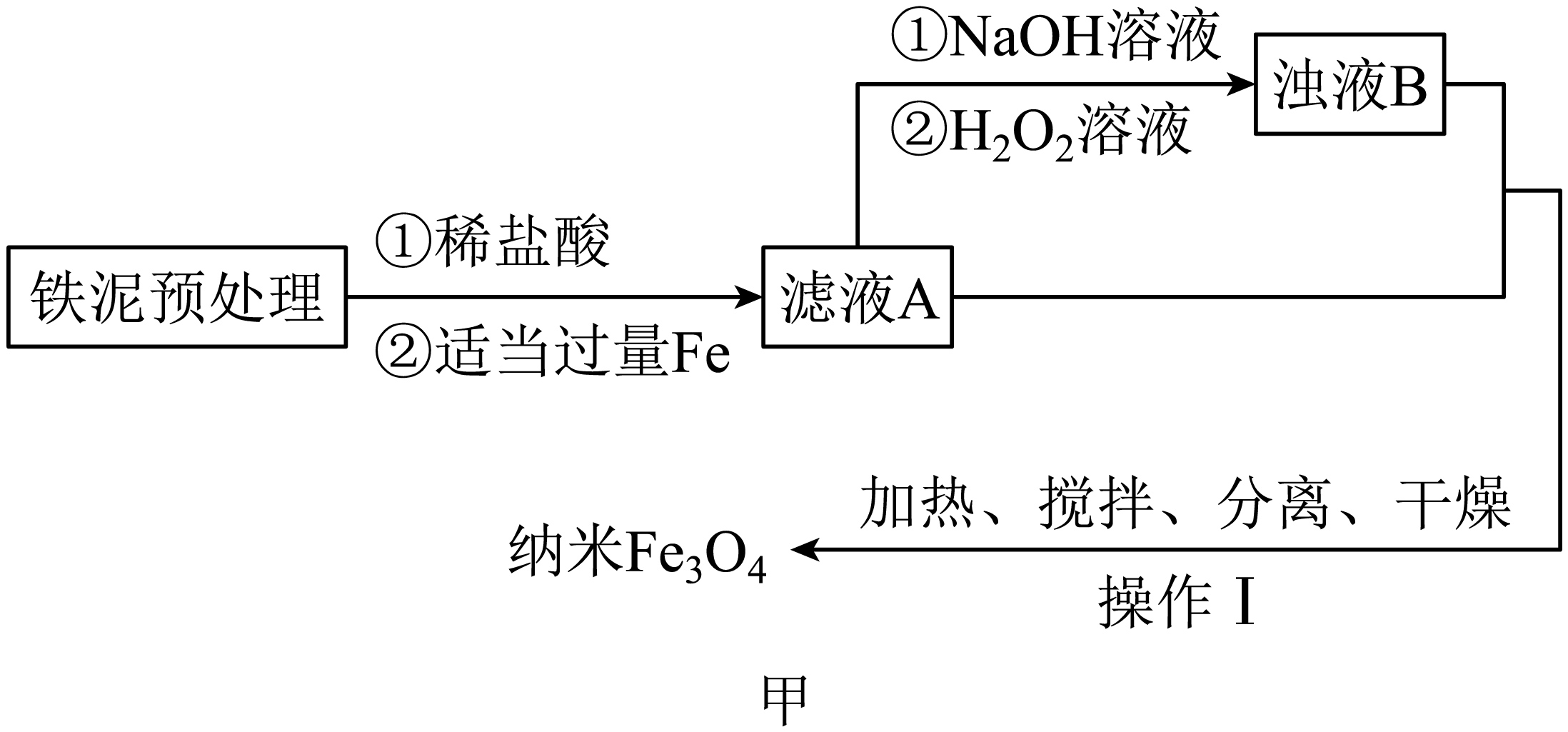
已知:①浊液$\rm B$中铁元素以$\rm FeOOH$形式存在;
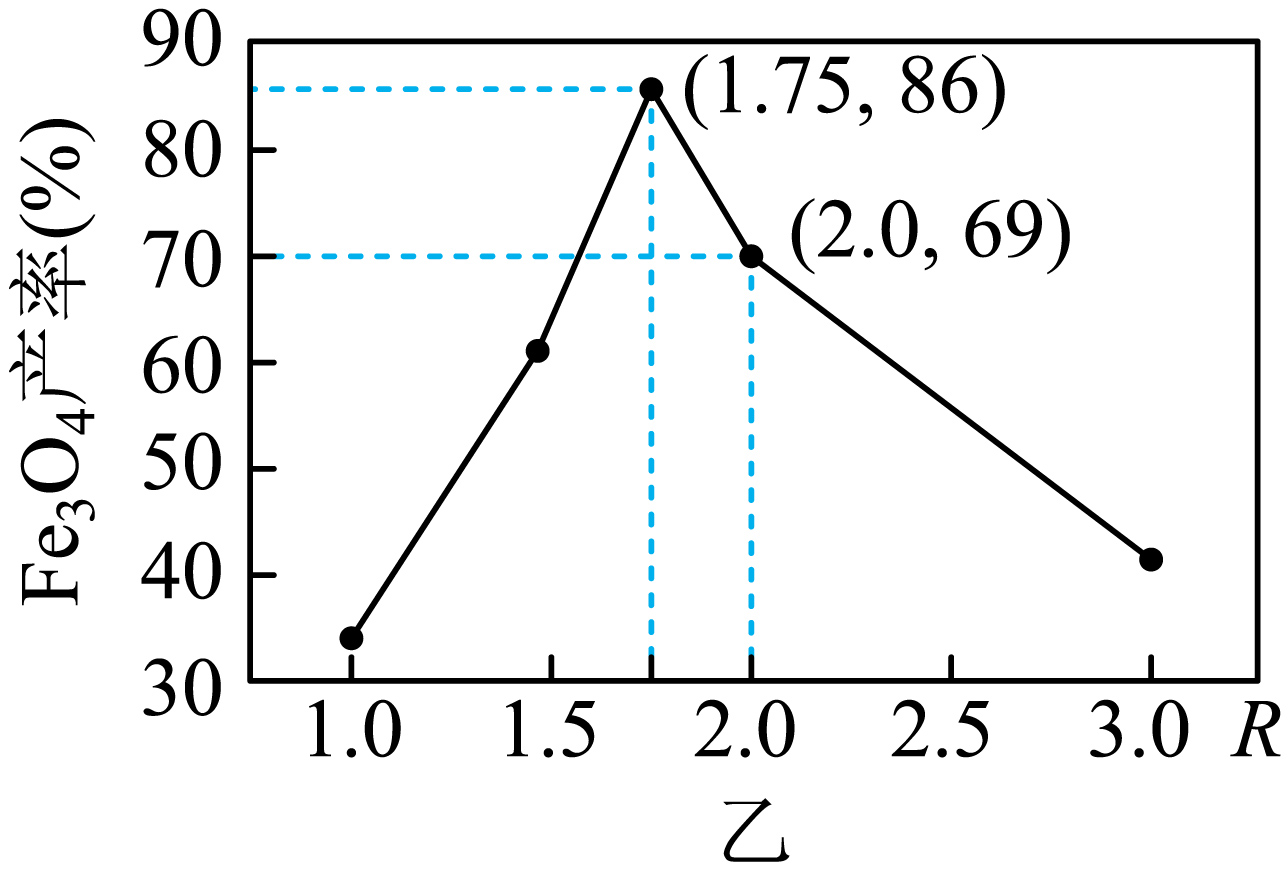
②在操作$\rm I$中,相同条件下测得$\text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}$的产率与$ {R}\left[ {R=}\dfrac{ {n}\left( \overset{\text{+3}}{\mathop{\text{Fe}}}\, \right)}{ {n}\left( \overset{\text{+2}}{\mathop{\text{Fe}}}\, \right)} \right]$的关系如图乙所示。
写出将$\rm A$转化为$\rm B$的离子方程式: 。
$2\\text{F}{{\\text{e}}^{2+}}+4\\text{O}{{\\text{H}}^{-}}+{{\\text{H}}_{2}}{{\\text{O}}_{2}}=2\\text{FeOOH}+2{{\\text{H}}_{2}}\\text{O}$
"]]由分析可知,浊液$\rm B$中的$\rm FeOOH$和滤液$\rm B$中的$\rm Fe^{2+}$,结合反应环境,可写出反应的离子方程式为$2\text{F}{{\text{e}}^{2+}}+4\text{O}{{\text{H}}^{-}}+{{\text{H}}_{2}}{{\text{O}}_{2}}=2\text{FeOOH}+2{{\text{H}}_{2}}\text{O}$。
反应完成后,将剩余的$\rm A$与$\rm B$混合,混合前需要加热$\rm B$一段时间,其加热的目的是 ;根据图乙可知,为使$\text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}$的产率最高,$ {R=}$ ,由此计算$\rm A$和$\rm B$所含铁物质的物质的量之比为 $\rm ($结果用最简整数比表示$\rm )$。
去除剩余${{\\text{H}}_{2}}{{\\text{O}}_{2}}$防止氧化为$\\rm +2$价$\\rm Fe$;$\\rm 1.75$;$\\dfrac{11}{7}$
"]]滤液$\rm B$中含有过量的$\rm H_{2}O_{2}$,混合前需要加热$\rm B$一段时间,其加热的目的是去除剩余$\rm {{{H}}_{2}}{{{O}}_{2}}$防止氧化为$\rm +2$价$\rm Fe$;由图可知,当$\rm {F}{{{e}}_{3}}{{{O}}_{4}}$的产率最高,${R=}\rm 1.75$;已知浊液$\rm B$中$\rm FeOOH$的物质的量为$a\;\rm mol$,即$\rm Fe^{3+}$的物质的量为$a\;\rm mol$,滤液$\rm A$中的铁元素的物质的量为$b\;\rm mol$,则与浊液$\rm D$中$\rm FeOOH$反应的$\rm Fe^{2+}$的物质的量为$(b-a)\;\rm mol$,由图象可知当$\rm Fe_{3}O_{4}$的产率最高时,${R=}\dfrac{{n}\left( \overset{{+3}}{\mathop{\rm {Fe}}}\, \right)}{{n}\left( \overset{{+2}}{\mathop{\rm {Fe}}}\, \right)}=1.75=\dfrac{{a}}{{b-a}}$,则$\rm A$和$\rm B$所含铁物质的物质的量之比为$\dfrac{{b}}{{a}}\rm =\dfrac{11}{7}$。
实验三:测定$\text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}$纳米材料的纯度
步骤$\rm 1$:称取一定量$\text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}$样品置于锥形瓶中,加入足量稀硫酸,加热使之完全溶解。
步骤$\rm 2$:向锥形瓶中滴加$4.000\;\rm \text{mol}\cdot {{\text{L}}^{-1}}{{\text{ K}}_{2}}\text{C}{{\text{r}}_{2}}{{\text{O}}_{7}}$溶液,发生反应:$\rm Cr_{2}O_{7}^{2-}\rm +6Fe^{2+}+14H^{+}= 2Cr^{3+}+6Fe^{3+}+7H_{2}O$,恰好完全反应时,共消耗$\rm 50.00\;\rm mL{{\text{ K}}_{2}}\text{C}{{\text{r}}_{2}}{{\text{O}}_{7}}$溶液。
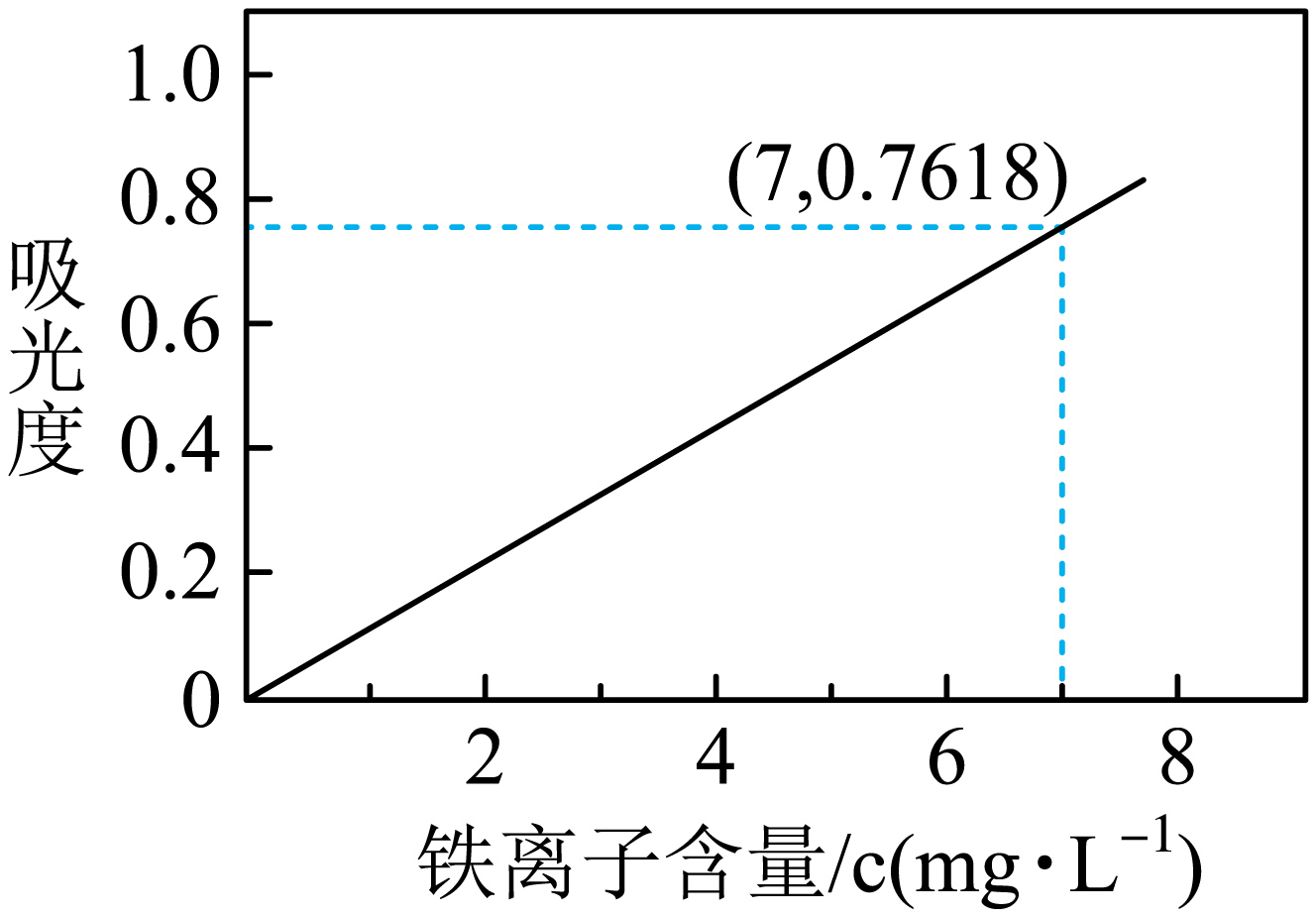
步骤$\rm 3$:将步骤$\rm 2$得到溶液配制成$\rm 1000\;\rm mL$溶液,取该溶液$\rm 1.00\;\rm mL$,稀释至$\rm 25.6\;\rm L$,测得溶液的吸光度为$\rm 0.7618$。
已知:吸光度与溶液中铁离子含量$(c)$的标准曲线如图所示:
步骤$\rm 3$中稀释溶液的原因是 。
减少$\\text{F}{{\\text{e}}^{3+}}$浓度,避免吸光过度
"]]$\text{F}{{\text{e}}^{3+}}$浓度过高会导致吸光过度,步骤$\rm 3$中稀释溶液的原因是减少$\rm Fe^{3+}$浓度,避免吸光过度。
经过上述测量和计算,$\text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}$样品中含有的杂质是 ,所取样品中$\text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}$的质量分数 。$\rm ($保留四位有效数字$\rm )$
$\\rm FeO$;$\\rm 87.88\\%$
"]]依据反应$\rm Cr_{2}O_{7}^{2-}\rm +6Fe^{2+}+14H^{+}= 2Cr^{3+}+6Fe^{3+}+7H_{2}O$可知$n\rm (Fe^{2+})=4\;\rm mol/L\times \rm 0.05\;\rm L\times \rm 6=1.2\;\rm mol$,将步骤$\rm 2$得到溶液配制成$\rm 1000\;\rm mL$溶液,取该溶液$\rm 1.00\;\rm mL$,稀释至$\rm 25.6\;\rm L$,测得溶液的吸光度为$\rm 0.7618$,对应的铁离子的含量为$\rm 7\;\rm mg/L$,则$\rm 25.6\;\rm L$稀释后的溶液中铁离子的含量为$\rm 25.6\;\rm L\times \rm 7\;\rm mg/L=179.2\;\rm mg=0.1792\;\rm g$,即$\rm 1\;\rm mL$配制后的溶液中含铁离子$\rm 0.1792\;\rm g$,则$\rm 1000\;\rm mL$配制后的溶液中含铁离子$\rm 179.2\;\rm g$,经过步骤$\rm 2$之后所得溶液中铁离子的物质的量为$\dfrac{\text{179}\text{.2 g}}{\text{56 g/mol}}\rm =3.2\;\rm mol$,样品中$n{\rm (Fe^{2+})}:n\rm (Fe^{3+})=3:8$,而$\rm Fe_{3}O_{4}$中$n{\rm (Fe^{2+})}:n\rm (Fe^{3+})=1:2$,说明样品中还存在别的$\rm Fe^{2+}$存在,则样品中含有的杂质是$\rm FeO$,设样品中$\rm Fe_{3}O_{4}(FeO\cdot \rm Fe_{2}O_{3})$的物质的量为$x\;\rm mol$,$\rm FeO$的物质的量为$y\;\rm mol$,则有$3x+y=3.2$,$x+y=1.2$,解得:$x=1$、$y=0.2$,样品中$\rm Fe_{3}O_{4}$的物质的量为$\rm 1\;\rm mol$,$\rm FeO$的物质的量为$\rm 0.2\;\rm mol$,所取样品中$\text{F}{{\text{e}}_{3}}{{\text{O}}_{4}}$的质量分数为$\dfrac{232}{160\times 0.2+232}\times 100\%\rm =87.88\%$。
高中 | 金属铁题目答案及解析(完整版)
