高中 | 氯气 题目答案及解析
稿件来源:高途
高中 | 氯气题目答案及解析如下,仅供参考!
必修一
第四章 非金属及其化合物
第二节 富集在海水中的元素——氯
氯气
向含有$\rm F{{e}^{2+}}$、$\rm {I}^{-}$、$\rm B{{r}^{-}}($已知还原性$\rm {{I}^{-}}\gt F{{e}^{2+}}\gt B{{r}^{-}})$的溶液中缓慢通入氯气,溶液中各种离子的物质的量变化如图所示。下列说法正确的是$\rm (\qquad)$
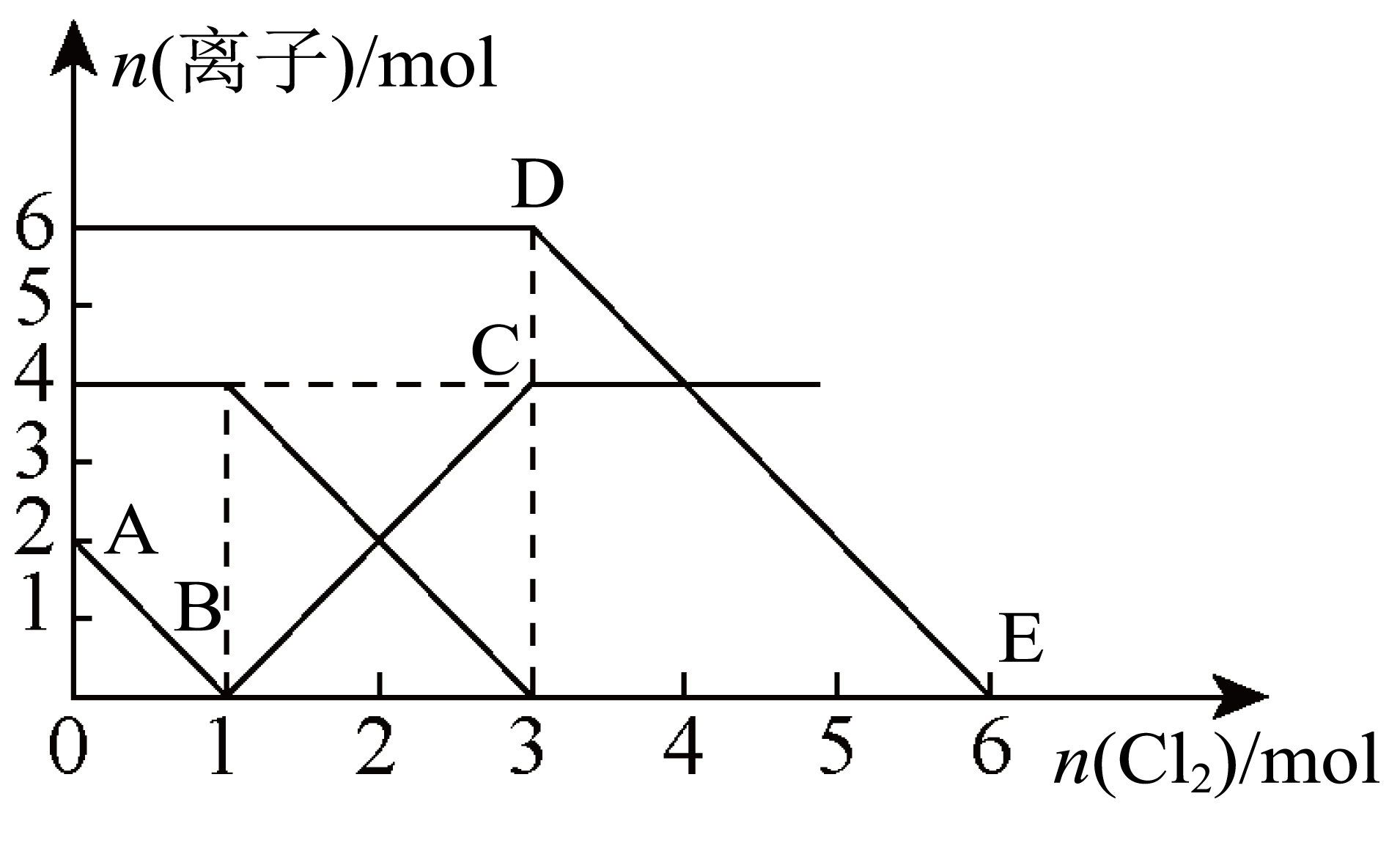
当通入$\\rm 2\\ mol\\ C{{l}_{2}}$时,溶液中发生的离子反应是:$\\rm 2F{{e}^{2+}}+2{{I}^{-}}+2C{{l}_{2}}=2F{{e}^{3+}}+{{I}_{2}}+4C{{l}^{-}}$
","$\\rm DE$段表示$n{\\rm (F{{e}^{2+}})}$的变化情况
","原溶液中$n{\\rm (F{{e}^{2+}})}:n{\\rm ({{I}^{-}})}:n{\\rm (B{{r}^{-}})}=3:1:2$
","$\\rm B$点时溶液中含有$\\rm {I}^{-}$和$\\rm B{{r}^{-}}$
"]还原性$\rm I^{-}\gt Fe^{2+}\gt Br^{-}$,向混合溶液中通入氯气时,氯气先氧化$\rm I^{-}$,然后再氧化$\rm Fe^{2+}$,最后氧化$\rm Br^{-}$。从图中可以看出,当通入$\rm 1\rm \ mol\ Cl_{2}$时,$\rm I^{-}$完全被氧化,发生的反应为:$\rm Cl_{2}+2I^{-}=I_{2}+2Cl^{-}$,所以$\rm I^{-}$的物质的量为$\rm 2\rm \ mol$。再通入$\rm 2\rm \ mol\ Cl_{2}$时,$\rm Fe^{2+}$被氧化:$\rm 2Fe^{2+}+Cl_{2}=2Fe^{3+}+2Cl^{-}$,所以$\rm Fe^{2+}$的物质的量为$\rm 4\rm \ mol$。最后再通入$\rm 3\rm \ mol\ Cl_{2}$,$\rm Br^{-}$被氧化:$\rm Cl_{2}+2Br^{-}=Br_{2}+2Cl^{-}$,所以$\rm Br^{-}$的物质的量为$\rm 6\rm \ mol$。
$\rm A$.当通入$\rm 2\rm \ mol\ Cl_{2}$时,$\rm I^{-}$全部被氧化,$\rm Fe^{2+}$被氧化了一半,所以溶液中发生的离子反应是:$\rm 2Fe^{2+}+2I^{-}+2Cl_{2}=2Fe^{3+}+I_{2}+4Cl^{-}$,故$\rm A$正确。
$\rm B$.由以上分析可知,$\rm DE$段表示$\rm Br^{-}$被氧化,所以表示的是$n{\rm (Br^{-})}$的变化情况,故$\rm B$错误。
$\rm C$.由以上分析可知,$n{\rm (Fe^{2+})}=4\rm \ mol$,$n{\rm (I^{-})}=2\rm \ mol$,$n{\rm (Br^{-})}=6\rm \ mol$,所以$n{\rm (Fe^{2+})}:n{\rm (I^{-})}:n{\rm (Br^{-})}=2:1:3$,故$\rm C$错误。
$\rm D$.由以上分析可知,$\rm B$点时$\rm I^{-}$刚好被氧化完全,所以$\rm B$点时溶液中含有未被氧化的$\rm Fe^{2+}$和$\rm Br^{-}$,故$\rm D$错误。
故选:$\rm A$
高中 | 氯气题目答案及解析(完整版)
