高中 | 导电的原因及条件 题目答案及解析
稿件来源:高途
高中 | 导电的原因及条件题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
导电的原因及条件
某学习小组在实验室进行了有关碘化铅$\rm (PbI_{2})$的实验探究。回答下列问题:
$\rm I$.制备$\rm PbI_{2}$的悬浊液
$\rm KI$溶液和$\rm Pb(NO_{3})_{2}$溶液反应,会产生金黄色的$\rm PbI_{2}$沉淀,形成美丽的“黄金雨”。
①$\rm KI$溶液在空气中久置会变质,其原因是 。
②生成$\rm PbI_{2}$的化学方程式为 。充分反应后,经系列操作得到纯净的$\rm PbI_{2}$固体,向其中加入蒸馏水,得到$\rm PbI_{2}$悬浊液。
$\\rm I^{-}$会被空气中的$\\rm O_{2}$氧化;$\\rm 2KI+2Pb(NO_{3})_{2}=PbI↓+2KNO_{3}$
"]]①$\rm I^{-}$具有较强还原性,会被空气中的$\rm O_{2}$氧化,导致$\rm KI$溶液变质。
②根据题意$\rm KI$和$\rm Pb(NO_{3})_{2}$发生复分解反应生成$\rm PbI_{2}$沉淀,根据元素守恒可得化学方程式为$\rm 2KI+2Pb(NO_{3})_{2}=PbI↓+2KNO_{3}$。
$\rm I$$\rm I$.探究浓度对$\rm PbI_{2}$沉淀溶解平衡的影响
$\rm [$查阅资料$\rm ]$ⅰ.温度一定时,强电解质稀溶液的电导率随溶液中离子浓度的增大而增大。
$\rm ii$.$\rm 26.5\ ^\circ \text{C}$时,$\rm PbI_{2}$饱和溶液的电导率为$\rm 368\ \mu S\cdot cm^{-1}$。
稀释对$\rm PbI_{2}$溶解平衡的影响
$26.5\ ^\circ \text{C}$时,向$\rm PbI_{2}$悬浊液中加入一定体积的蒸馏水,通过图甲所示装置测定电导率,并得到电导率随时间变化的曲线$\rm ($图乙$\rm )$。
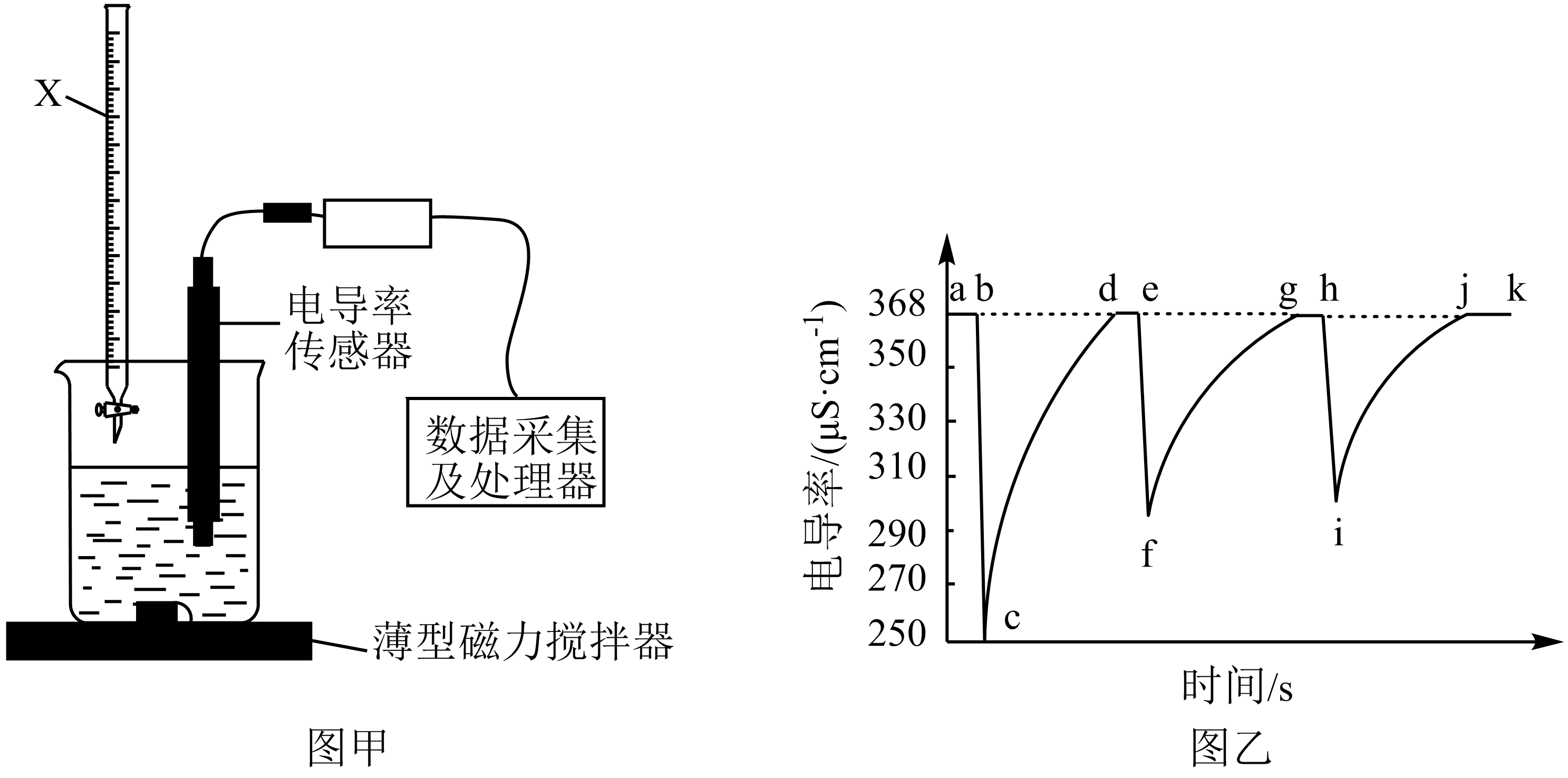
①实验装置中仪器$\rm X$的名称为 。
②由电导率变化曲线可知:实验中通过仪器$\rm X$加入蒸馏水的方式是 $\rm ($填标号$\rm )$。
$\rm A$.连续逐滴加入
$\rm B$.分三次快速放入
$\rm C$.一次性快速放入
③曲线图中, 段$\rm ($用字母表示,任写一段$\rm )$表示$\rm PbI_{2}$固体的溶解达到平衡状态:$\rm c→d$段溶液的电导率逐渐增大的原因是 导致了溶液中离子浓度不断增大。
酸式滴定管;$\\rm B$;$\\rm ab$或$\\rm ba($答“$\\rm de$”“$\\rm ed$”“$\\rm gh$”“$\\rm hg$”“$\\rm jk$”“$\\rm kj$”均可$\\rm )$;$\\rm PbI_{2}$固体不断溶解
"]]①根据仪器$\rm X$的结构特点可知其为酸式滴定管。
②由电导率变化曲线可知,电导率出现$\rm 3$次急剧的下降,说明蒸馏水是分三次快速放入。
③悬浊液导电是因为存在平衡$\rm PbI_{2}\rightleftharpoons Pb^{2+}+2I^{-}$,加水稀释后,离子浓度瞬间下降,电导率瞬间减小,之后反应正向移动,$\rm PbI_{2}$固体不断溶解,重新达到平衡,而$\rm PbI_{2}$饱和溶液中$\rm Pb^{2+}$和$\rm I^{-}$的浓度不变,所以平衡后电导率相同,即$\rm ab$、$\rm de$、$\rm gh$、$\rm jk$均可以表示$\rm PbI_{2}$固体的溶解达到平衡状态,而$\rm c→d$段溶液的电导率逐渐增大的原因是$\rm PbI_{2}$固体不断溶解,导致了溶液中离子浓度不断增大。
$c{\rm (KI)}$对$\rm PbI_{2}$沉淀溶解平衡的影响
$26.5\ ^\circ \text{C}$时,将$\rm PbI_{2}$悬浊液静置后,取$\rm 200\ mL$上层清液$[c{\rm (I^{-})}=2.5\times 10^{-3}\rm \ mol\cdot L^{-1}]$于烧杯中,另取蒸馏水于相同规格的烧杯中进行对比实验,再分别向其中加入$\rm 1\ mol\cdot L^{-1}\ KI$溶液。实验数据记录如表:
| $\rm KI$溶液累计加入量$\rm /mL$ | 电导率$\rm /(\mu S\cdot cm^{-1})$ | |
| $\rm PbI_{2}$饱和溶液 | 蒸馏水 | |
| $\rm 0$ | $\rm 368$ | $\rm 4$ |
| $\rm 0.50$ | $\rm A_{1}$ | $\rm B_{1}$ |
| $\rm 1.00$ | $\rm A_{2}$ | $\rm B_{2}$ |
①上述实验过程中,增大$\rm PbI_{2}$饱和溶液中$\rm I^{-}$的浓度,可观察到的实验现象是 。
②利用蒸馏水进行对比实验时,所取蒸馏水的体积为 $\rm \ mL$。
③表格数据$\rm A_{2}-A_{1}$ $\rm B_{2}-B_{1}($填“大于”“小于”或“等于”$\rm )$,说明增大$\rm KI$的浓度,$\rm PbI_{2}$沉淀溶解平衡向生成沉淀的方向移动。
产生金黄色沉淀$\\rm ($或“产生亮黄色沉淀”“产生黄色浑浊”$\\rm )$;$\\rm 200$;小于
"]]①增大$\rm PbI_{2}$饱和溶液中$\rm I^{-}$的浓度,沉淀溶解平衡逆向移动,清液中产生金黄色的$\rm PbI$沉淀。
②为保证变量唯一,所用蒸馏水的体积应与所用“上层清液”的体积相同,即$\rm 200\ mL$。
③增大$\rm KI$的浓度,$\rm PbI_{2}$沉淀溶解平衡向生成沉淀的方向移动,导致溶液中的离子浓度减小,电导率的变化会小于蒸馏水中,所以$\rm A_{2}-A_{1}$小于$\rm B_{2}-B_{1}$。
高中 | 导电的原因及条件题目答案及解析(完整版)
