高中 | 氧化还原反应方程式的书写及配平 题目答案及解析
稿件来源:高途
高中 | 氧化还原反应方程式的书写及配平题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第三节 氧化还原反应
氧化还原反应方程式的书写及配平
$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$是重要的化工原料,易溶于水。在中性或碱性环境中稳定。制备$\mathrm{Na}_{2} \mathrm{S}_{2} \mathrm{O}_{3} \cdot 5 \mathrm{H}_{2} \mathrm{O}$的反应原理:$\text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{3}}(\text{aq})+\text{S}(\text{s})\begin{matrix} \underline{\underline{\triangle}} \\ {} \\ \end{matrix}\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}(\text{aq})$。
实验步骤:
①称取$15\text{\ g\ N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{3}}$加入圆底烧瓶中,再加入$80\;\rm \text{mL}$蒸馏水。另取$5\text{g}$研细的硫粉,用$3\;\rm \text{mL}$乙醇润湿,加入上述溶液中。
②安装实验装置$\rm ($如图所示,部分加持装置略去$\rm )$,水浴加热,微沸$60$分钟。
③趁热过滤,将滤液水浴加热浓缩,冷却析出$\mathrm{Na}_{2} \mathrm{S}_{2} \mathrm{O}_{3} \cdot 5 \mathrm{H}_{2} \mathrm{O}$,经过滤,洗涤,干燥,得到产品。
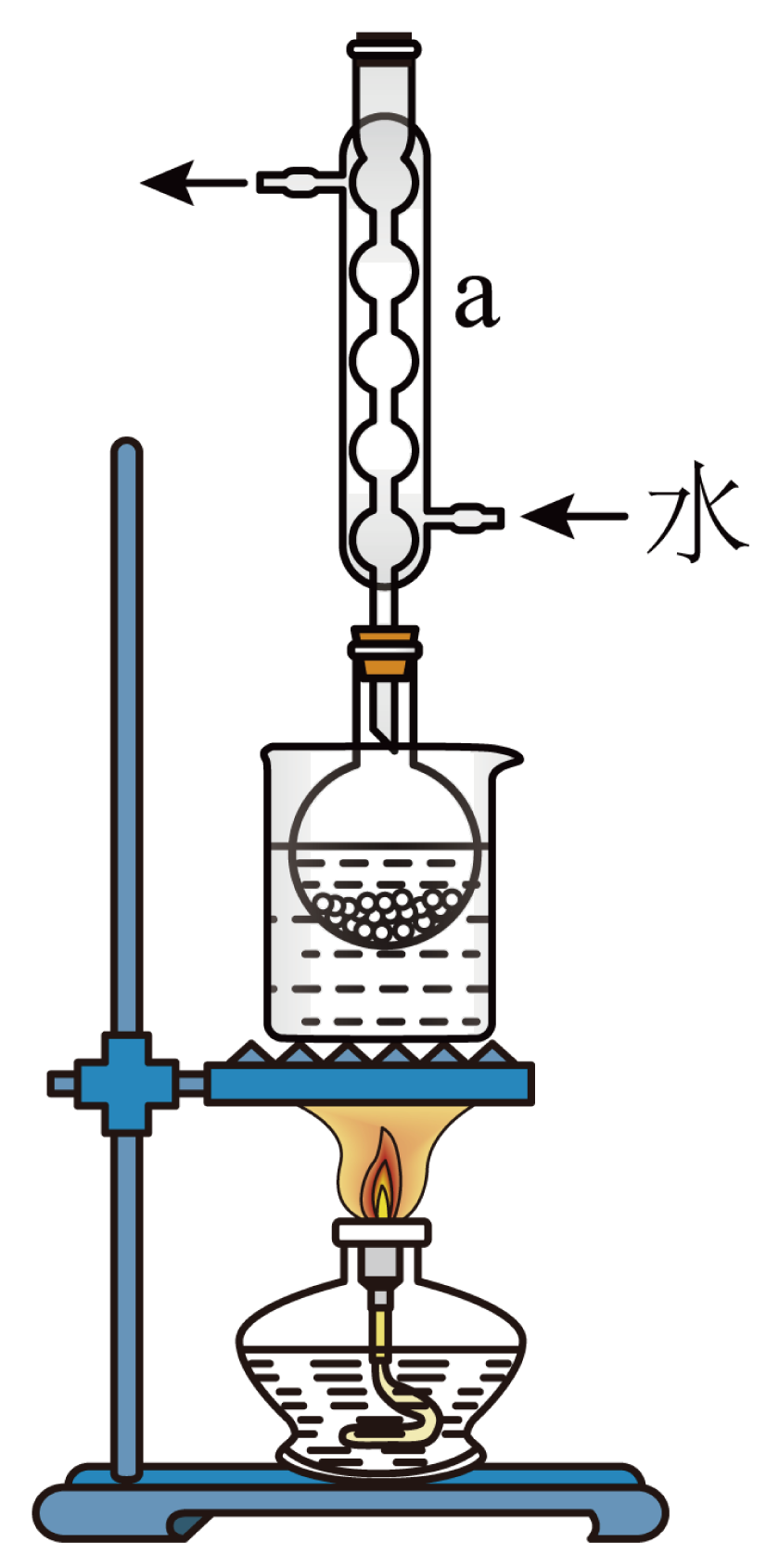
回答下列问题:
仪器$\rm \ a$的名称是 。
$\\rm ($球形$\\rm )$冷凝管
"]]根据实验装置图可知$\rm \ a$为$\rm ($球形$\rm )$冷凝管;
硫粉在反应前用乙醇润湿的目的是 。
使硫粉易于分散到溶液中$\\rm ($或增大接触面积,或使反应更充分,或加快反应速率等$\\rm )$
"]]硫粉难溶于水微溶于乙醇,所以硫粉在反应前用乙醇润湿的目的是使硫粉易于分散到溶液中。
产品中除了有未反应的$\text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{3}}$外,最可能存在的无机杂质是 。
$\\text{N}{{\\text{a}}_{2}}\\text{S}{{\\text{O}}_{4}}$
"]]$\rm SO_{\text{3}}^{\text{2-}}$具有还原性,能被$\rm O_{2}$氧化为$\rm SO_{\text{4}}^{\text{2-}}$,所以最可能存在的无机杂质是$\rm Na_{2}SO_{4}$。
该实验一般控制在碱性环境下进行,否则产品发黄,用离子方程式表示其原因: 。
$\\mathrm{S}_{2} \\mathrm{O}_{3}^{2-}+2 \\mathrm{H}^{+}=\\mathrm{S} \\downarrow+\\mathrm{SO}_{2} \\uparrow+\\mathrm{H}_{2} \\mathrm{O}$
"]]$\rm S_{2}O_{\text{3}}^{\text{2-}}$与$\rm H^{+}$发生氧化还原反应,生成的单质$\rm S$使产品发黄,离子方程式为:$\mathrm{S}_{2} \mathrm{O}_{3}^{2-}+2 \mathrm{H}^{+}=\mathrm{S} \downarrow+\mathrm{SO}_{2} \uparrow+\mathrm{H}_{2} \mathrm{O}$;
测定产品纯度:准确称取${W\ \rm g}$产品,用适量蒸馏水溶解,以淀粉作指示剂,用$0.1000\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$碘的标准溶液滴定。反应原理为:$2{{\text{S}}_{2}}\text{O}_{3}^{2-}+{{\text{I}}_{2}}={{\text{S}}_{4}}\text{O}_{6}^{2-}+2{{\text{I}}^{-}}$。滴定时消耗碘的标准溶液体积为$18.10\;\rm \text{mL}$,则产品的纯度为$\rm ($设$\mathrm{Na}_{2} \mathrm{S}_{2} \mathrm{O}_{3} \cdot 5 \mathrm{H}_{2} \mathrm{O}$相对分子质量为$\rm M)$ 。
$\\dfrac{3.620\\times {{10}^{-3}}{M}}{{W}}\\times 100\\text{ }\\!\\!\\%$
"]]根据$2{{\text{S}}_{2}}\text{O}_{3}^{2-}+{{\text{I}}_{2}}={{\text{S}}_{4}}\text{O}_{6}^{2-}+2{{\text{I}}^{-}}$体现的关系可知,产品的纯度为$ 0.1000{\;\rm mol/L}\times 18.10\times 10^{-3}\;\text L\times 2M\div W\times 100\%=\dfrac{\text{3}\text{.620}\times \text{1}{{\text{0}}^{{-3}}}{M}}{{W}}\times 100\%$;
在滴定过程中,下列操作会导致测定结果偏低的是$(\quad\ \ \ \ )\rm ($填序号$\rm )$。
滴定前有气泡,滴定后气泡消失
","滴定前读数正确,滴定后俯视读数
","滴定过程中向锥形瓶中加少量蒸馏水冲洗内壁
"]$\rm A$.滴定前有气泡,滴定后气泡消失,使得标准液用量增大,测定结果偏大,$\rm A$不符合题意;
$\rm B$.滴定前读数正确,滴定后俯视读数,使得标准液用量偏小,测定结果偏低,$\rm B$符合题意;
$\rm C$.滴定过程中向锥形瓶中加少量蒸馏水冲洗内壁,不影响标准液用量,$\rm C$不符合题意;
高中 | 氧化还原反应方程式的书写及配平题目答案及解析(完整版)
