高中 | 铁盐 亚铁盐 题目答案及解析
稿件来源:高途
高中 | 铁盐 亚铁盐题目答案及解析如下,仅供参考!
必修一
第三章 金属及其化合物
第二节 几种重要的金属化合物
铁盐 亚铁盐
碱式硫酸铁$\rm [\text{Fe}\left( \text{OH} \right)\text{S}{{\text{O}}_{\text{4}}}\rm ]$是一种新型高效絮凝剂,常用于污水处理,在医疗上也可用于治疗消化性溃疡出血。工业上利用废铁屑$\rm ($含少量氧化铝等$\rm )$生产碱式硫酸铁的工艺流程如下所示:
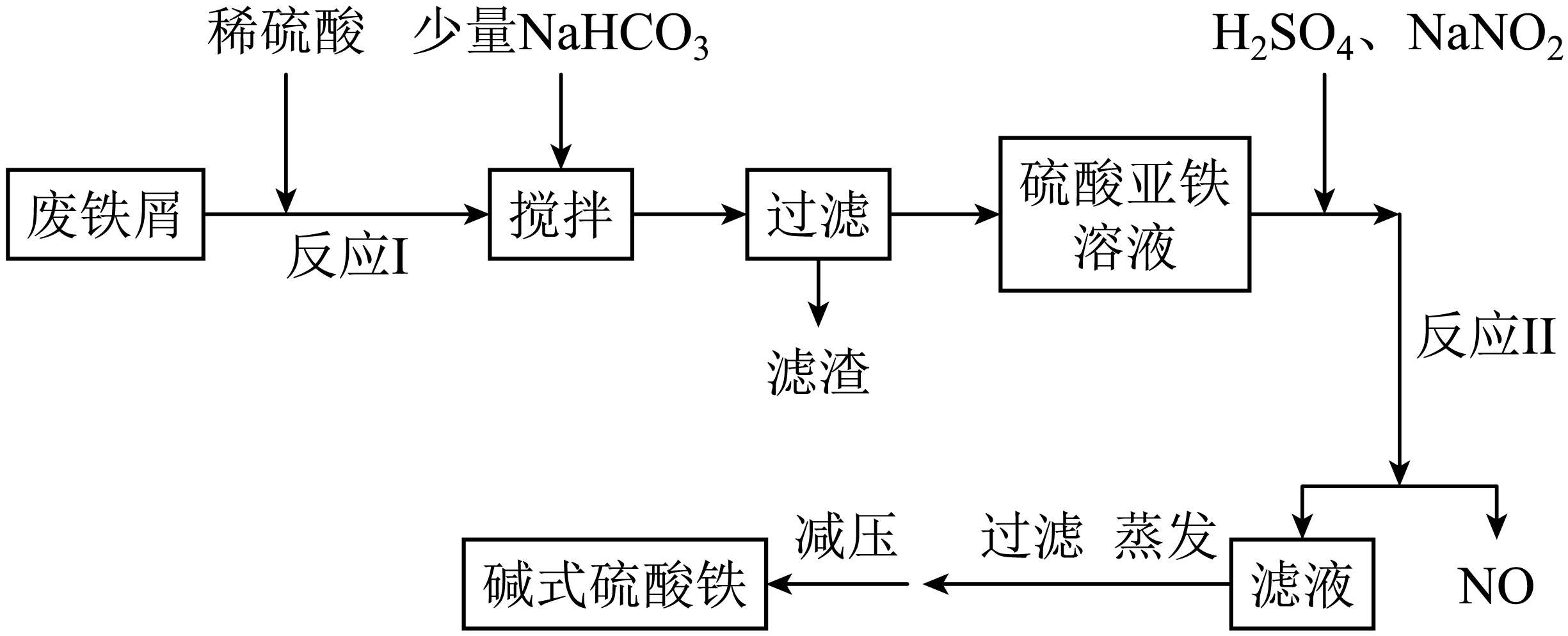
部分正离子以氢氧化物形式沉淀时溶液的$\rm pH$如表所示:
| 沉淀物 | $\text{Fe}{{\left( \text{OH} \right)}_{\text{3}}}$ | $\text{Fe}{{\left( \text{OH} \right)}_{2}}$ | $\text{Al}{{\left( \text{OH} \right)}_{3}}$ |
| 开始沉淀 | $\rm 2.3$ | $\rm 7.5$ | $\rm 3.4$ |
| 完全沉淀 | $\rm 3.2$ | $\rm 9.7$ | $\rm 4.4$ |
请回答下列问题:
加入少量$\rm NaHCO_{3}$的目的是将溶液的$\rm pH$条件至 范围,以除去$\text{A}{{\text{l}}^{3+}}$,可能发生的离子方程式为 。
$\\rm 4.4-7.5$ ; $\\text{A}{{\\text{l}}^{3+}}+3\\text{HCO}_{3}^{-}=\\text{Al}{{\\left( \\text{OH} \\right)}_{3}}\\downarrow +3\\text{C}{{\\text{O}}_{2}}\\uparrow $
"]]该工艺流程的目的为生产碱式硫酸铁,废铁屑中含少量氧化铝等杂质,所以要除去$\rm Al$保留$\rm Fe$;加入稀硫酸发生反应Ⅰ,则反应Ⅰ所得溶液中含有$\rm Fe^{2+}$、$\rm Al^{3+}$、$\rm H^{+}$、$\text{SO}_{4}^{2-}$等,加入少量$\rm NaHCO_{3}$调节$\rm pH$,且控制$\rm pH$使$\rm Al^{3+}$ 完全沉淀,而$\rm Fe^{2+}$ 不沉淀,根据表格数据可推断,$\rm pH$应控制在$\rm 4.4$~$\rm 7.5$范围内,除去$\text{A}{{\text{l}}^{3+}}$可能发生的离子方程式为$\text{A}{{\text{l}}^{3+}}+3\text{HCO}_{3}^{-}=\text{Al}{{\left( \text{OH} \right)}_{3}}\downarrow +3\text{C}{{\text{O}}_{2}}\uparrow $;
在实际生产中,反应Ⅱ中常同时通入$\rm O_{2}$,以减少$\rm NaNO_{2}$的用量,$\rm O_{2}$与$\rm NaNO_{2}$在反应中均作 。若参与反应的$\rm O_{2}$有$\rm 11.2\;\rm L($标准状况$\rm )$,则相当于节约了 $\rm \;\rm mol$ $\rm NaNO_{2}$。
氧化剂 ; $\\rm 2$ $\\rm mol$
"]]根据流程可知,反应Ⅱ中硫酸亚铁转化为硫酸铁,所以通入的$\rm O_{2}$ 与$\rm NaNO_{2}$ 均作氧化剂;若有$\rm 11.2$ $\rm L$ $\rm O_{2}$即$\rm 0.5$ $\rm mol$ $\rm O_{2}$参与反应,则转移电子$\rm 2$ $\rm mol$;若用$\rm NaNO_{2}$作氧化剂,还原产物为$\rm NO$,每$\rm 1$ $\rm mol$ $\rm NaNO_{2}$转移$\rm 1$ $\rm mol$电子,所以标况下$\rm 11.2$ $\rm L$ $\rm O_{2}$ 相当于$\rm 2$ $\rm mol$ $\rm NaNO_{2}$;
碱式硫酸铁溶于水后产生的$\text{Fe}{{\left( \text{OH} \right)}^{2+}}$可部分水解生成$\text{F}{{\text{e}}_{2}}\left( \text{OH} \right)_{4}^{2+}$,该水解反应的离子方程式为 。
$2\\text{Fe}{{\\left( \\text{OH} \\right)}^{2+}}+2{{\\text{H}}_{2}}\\text{O}\\rightleftharpoons \\text{F}{{\\text{e}}_{2}}\\left( \\text{OH} \\right)_{4}^{2+}+2{{\\text{H}}^{+}}$
"]]碱式硫酸铁溶于水后产生的$\text{Fe}{{\left( \text{OH} \right)}^{2+}}$可部分水解生成$\text{F}{{\text{e}}_{2}}\left( \text{OH} \right)_{4}^{2+}$,水解反应的离子方程式为$2\text{Fe}{{\left( \text{OH} \right)}^{2+}}+2{{\text{H}}_{2}}\text{O}\rightleftharpoons \text{F}{{\text{e}}_{2}}\left( \text{OH} \right)_{4}^{2+}+2{{\text{H}}^{+}}$;
在医药上常用硫酸亚铁与硫酸、硝酸的混合液反应制备碱式硫酸铁。根据我国质量标准,产品中不得含有$\text{F}{{\text{e}}^{2+}}$及$\text{NO}_{3}^{-}$。为检验所得的产品中是否含有$\text{F}{{\text{e}}^{2+}}$,应当先用稀硫酸溶解样品。请简述后续的检验方法: 。
滴加$\\rm KMnO_{4}$溶液或铁氰化钾,高锰酸钾溶液不褪色或不产生蓝色沉淀,说明产品中不含$\\text{F}{{\\text{e}}^{2+}}$
"]]后续的检验方法为:滴加$\rm KMnO_{4}$溶液或铁氰化钾,高锰酸钾溶液不褪色或不产生蓝色沉淀,说明产品中不含$\text{F}{{\text{e}}^{2+}}$。
高中 | 铁盐 亚铁盐题目答案及解析(完整版)
