高中 | 化学平衡图像分析 题目答案及解析
稿件来源:高途
高中 | 化学平衡图像分析题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡图像分析
$\rm CO_{2}$和$\rm SO_{2}$的大量排放会对环境产生影响,科学家在积极探索用化学方法吸收并综合利用$\rm CO_{2}$和$\rm SO_{2}$。
$\rm I$.重整吸收$\rm CO_{2.}$主要反应如下:
①$\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+\text{C}{{\text{H}}_{\text{4}}}\left( \text{g} \right)\rightleftharpoons 2{{\text{H}}_{\text{2}}}\left( \text{g} \right)+\text{2CO}\left( \text{g} \right)\text{ }-{{\text{Q}}_{\text{1}}}$ $(Q_{1}$大于$\rm 0)$
②$\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons {{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)+\text{CO}\left( \text{g} \right)\text{ }-{{\text{Q}}_{\text{2}}}$ $(Q_{2}$大于$\rm 0)$
在容积固定的某密闭容器中,反应物投料比按$n\left( \text{C}{{\text{O}}_{\text{2}}} \right):n\left( \text{C}{{\text{H}}_{4}} \right)=1:1$发生上述反应,$\rm CO_{2}$、$\rm CH_{4}$的平衡转化率随温度变化的曲线如图所示。
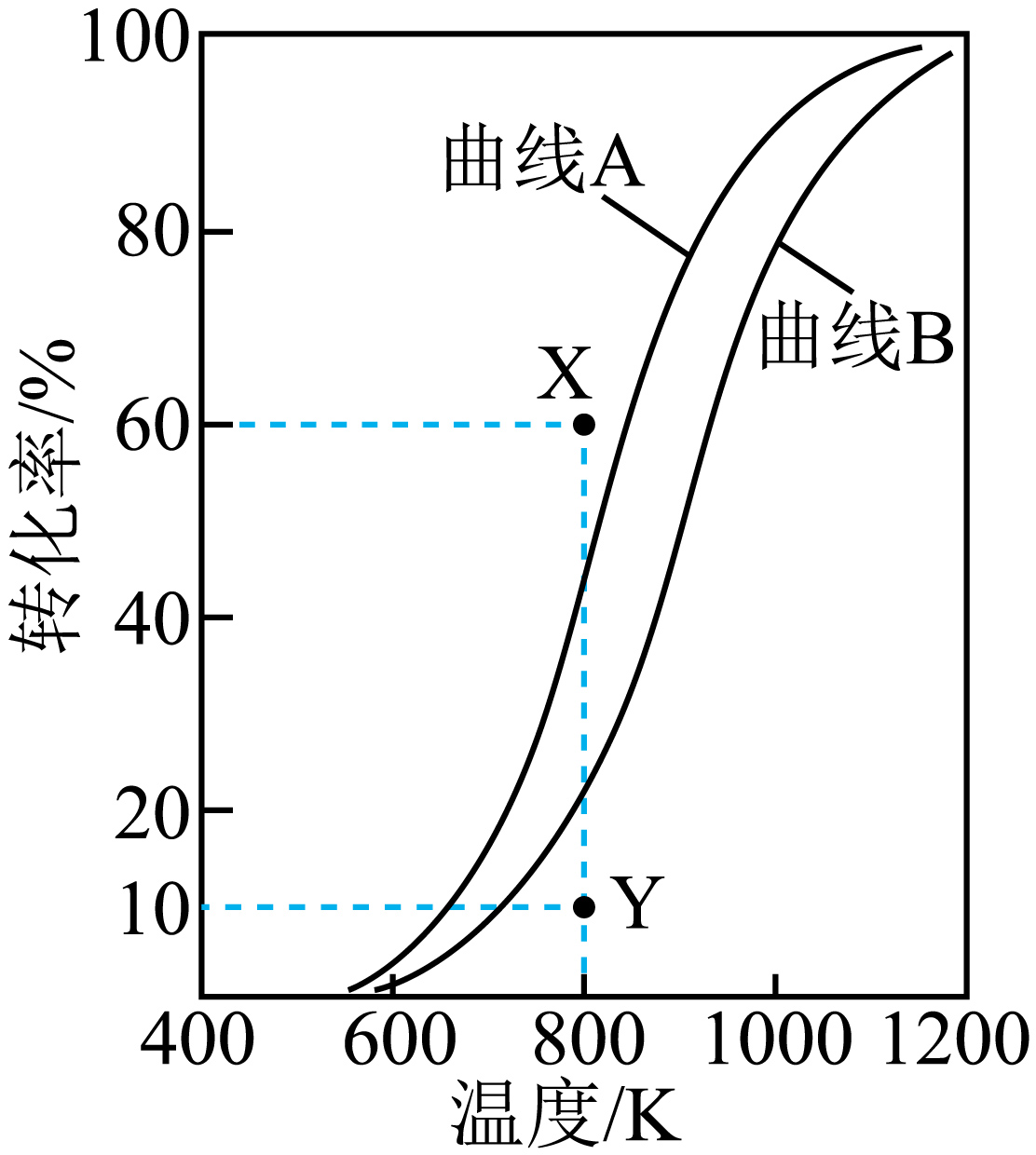
根据消耗情况可以判断:图中曲线 $\rm ($选填“$\rm A$”或“$\rm B$”$\rm )$表示$\rm CO_{2}$的平衡转化率随温度的变化趋势。提高$\rm CH_{4}$的平衡转化率的措施为 $\rm ($列举一条$\rm )$。
$\\rm A$ ; 增加二氧化碳的投料等
"]]反应①中$\rm CO_{2}$、$\rm CH_{4}$的转化率相同,但是二氧化碳也参与反应②的转化,故二氧化碳转化率高于甲烷,结合图像可知,图中曲线$\rm A$表示$\rm CO_{2}$的平衡转化率随温度的变化趋势。提高$\rm CH_{4}$的平衡转化率的措施为增加二氧化碳的投料、减小压强、降低温度等;
图中$\rm X$点的$v(\rm CH_{4}$,正$\rm )$ $v\rm (CH_{4}$,逆$\rm )$。$\rm ($选填“$\rm \gt $”、“$\rm \lt $”或“$\rm =$”$\rm )$若起始$c\left( \text{C}{{\text{O}}_{2}} \right)=2\,\text{mol/L}$,反应至$\rm 5$ $\rm min$时,$\rm CH_{4}$的转化率到达$\rm Y$点,且$c\left( {{\text{H}}_{\text{2}}} \right)$为$\rm 0.2$ $\rm mol·L^{-1}$,则$\rm 0$~$\rm 5$ $\rm min$内$\rm H_{2}O(g)$的平均反应速率$v=$ $\rm \;\rm mol·L^{-1}·min^{-1}$。
$\\rm \\lt $ ; $\\rm 0.04$
"]]图中$\rm X$点的转化率高于平衡时的转化率,故反应逆向进行,$v$ $\rm (CH_{4}$,正$)\lt v$ $\rm (CH_{4}$,逆$\rm )$;
在容积固定的某密闭容器中,反应物投料比按$n\left( \text{C}{{\text{O}}_{2}} \right):n\left( \text{C}{{\text{H}}_{4}} \right)=1:1$发生上述反应;若起始$c\left( \text{C}{{\text{O}}_{\text{2}}} \right)=2\,\text{mol/L}$,反应至$\rm 5$ $\rm min$时,$\rm CH_{4}$的转化率到达$\rm Y$点,则反应二氧化碳$\rm 0.2$ $\rm mol·L^{-1}$,反应①生成氢气$\rm 0.4$ $\rm mol·L^{-1}$,由于此时$c\left( {{\text{H}}_{\text{2}}} \right)$为$\rm 0.2$ $\rm mol·L^{-1}$,则反应②消耗氢气$\rm 0.2$ $\rm mol·L^{-1}$、生成水$\rm 0.2$ $\rm mol·L^{-1}$,故$\rm 0$~$\rm 5$ $\rm min$内$\rm H_{2}O(g)$的平均反应速率$v=\dfrac{\text{0}\text{.2}\,\text{mol}\cdot {{\text{L}}^{\text{-1}}}}{\text{5}\,\text{min}}=\text{0}\text{.04}\,\text{mol}\cdot {{\text{L}}^{\text{-1}}}\cdot \text{mi}{{\text{n}}^{\text{-1}}}$;
$\rm I$$\rm I$.$\rm ZnO$悬浊液吸收$\rm SO_{2}$,再催化氧化得到硫酸盐。
向$\rm ZnO$悬浊液中缓缓通入$\rm SO_{2}$,$\rm SO_{2}$吸收率及溶液$\rm pH$变化如图所示。已知:$\rm ZnSO_{3}$微溶于水,$\rm Zn(HSO_{3})_{2}$易溶于水。
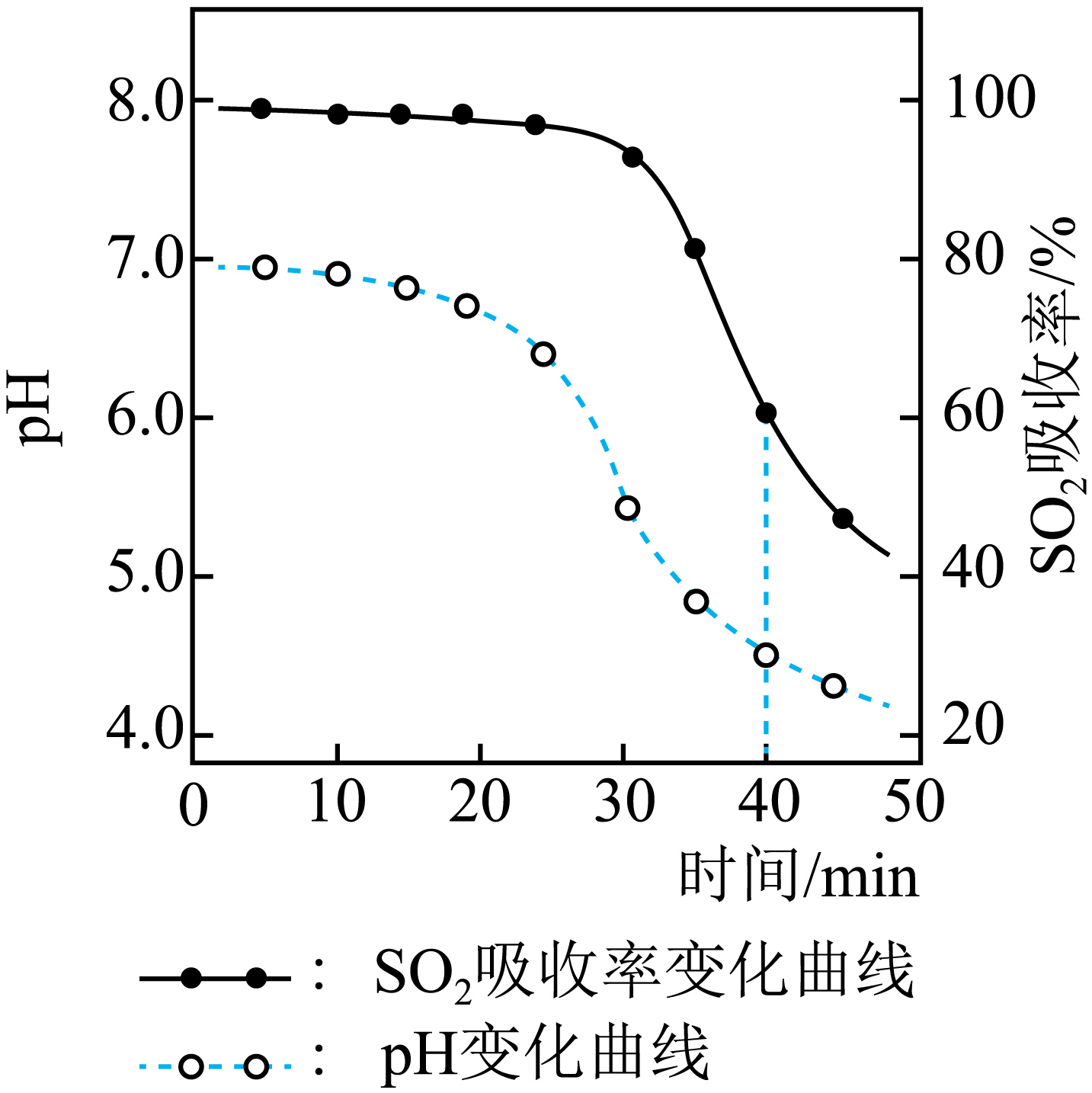
在$\rm 0$~$\rm 10$ $\rm min$,溶液$\rm pH$几乎保持不变,该阶段主要产物为 $\rm ($填化学式$\rm )$;在$\rm 30$~$\rm 40$ $\rm min$,$\rm SO_{2}$吸收率迅速降低,该阶段主要反应的离子方程式为 。
$\\rm ZnSO_{3}$ ; $\\text{ZnS}{{\\text{O}}_{\\text{3}}}\\text{+S}{{\\text{O}}_{\\text{2}}}+{{\\text{H}}_{\\text{2}}}\\text{O=Z}{{\\text{n}}^{2+}}\\text{+2HSO}_{\\text{3}}^{-}$
"]]在$\rm 0$~$\rm 10$ $\rm min$,氧化锌悬浊液吸收二氧化硫生成微溶的亚硫酸锌,溶液$\rm pH$几乎保持不变,故该阶段主要产物为$\rm ZnSO_{3}$;在$\rm 30$~$\rm 40$ $\rm min$,生成的$\rm ZnSO_{3}$和过量的二氧化硫生成易溶于水的$\rm Zn(HSO_{3})_{2}$,此时$\rm pH$迅速下降,生成的亚硫酸根离子抑制二氧化硫的吸收,导致$\rm SO_{2}$吸收率迅速降低,该阶段主要反应的离子方程式为$\text{ZnS}{{\text{O}}_{\text{3}}}\text{+S}{{\text{O}}_{\text{2}}}+{{\text{H}}_{\text{2}}}\text{O=Z}{{\text{n}}^{2+}}\text{+2HSO}_{\text{3}}^{-}$;
调节吸收$\rm SO_{2}$所得溶液的$\rm pH$为$\rm 4.5$~$\rm 6.5$,缓缓通入$\rm O_{2}$,则溶液$\rm pH$将 $\rm ($选填“增大”、“减小”或“不变”$\rm )$。
减小
"]]缓缓通入$\rm O_{2}$,则溶液中$\text{HSO}_{\text{3}}^{-}$被氧气氧化为硫酸根离子,$\text{2HSO}_{\text{3}}^{-}+{{\text{O}}_{\text{2}}}\text{=2SO}_{\text{4}}^{\text{2-}}\text{+2}{{\text{H}}^{+}}$,溶液酸性增强,$\rm pH$减小。
高中 | 化学平衡图像分析题目答案及解析(完整版)
