高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
甲醇是一种重要的化工原料,具有广阔的开发和应用前景。工业上使用水煤气$\rm (CO$与$\rm H_{2}$的混合气体$\rm )$转化成甲醇$\rm (CH_{3}OH)$。
一定条件下,根据下列反应及焓变,补全水煤气转化成甲醇的热化学方程式:
$\rm CO(g)+H_{2}O(g)\rightleftharpoons \rm CO_{2}(g)+H_{2}(g)$ $\quad \Delta H_{1}=-41.2\;\rm kJ/mol$
$\rm CH_{3}OH(g)+H_{2}O(g)\rightleftharpoons \rm CO_{2}(g)+3H_{2}(g)$ $\quad \Delta H_{2}=+49.5\;\rm kJ/mol$
$\rightleftharpoons \rm CH_{3}OH(g)$ $\quad \Delta H$
$\\rm CO\\left( \\text{g} \\right)+2{{\\text{H}}_{2}}\\left( \\text{g} \\right)$ $-90.7\\;\\rm kJ/mol$
"]]令①为$\rm CO(g)+H_{2}O(g)\rightleftharpoons \rm CO_{2}(g)+H_{2}(g)$ $\quad \Delta H_{1}=-41.2\;\rm kJ/mol$,②为$\rm CH_{3}OH(g)+H_{2}O(g)\rightleftharpoons \rm CO_{2}(g)+3H_{2}(g)$ $\quad \Delta H_{2}=+49.5\;\rm kJ/mol$,根据盖斯定律,①$\rm -$②,可得:$\rm CO\left( \text{g} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons C{{H}_{3}}OH\left( \text{g} \right)\quad \Delta {H}=\Delta {{{H}}_{1}}-\Delta {{{H}}_{2}}$,则$\Delta {H}=\left( -41.2-49.5 \right)kJ/mol=-90.7\;\rm kJ/mol$。
在体积可变的恒压密闭容器中投入$\rm 1\;\rm mol\;\rm CO$和$\rm 1.5\;\rm mol\;\rm H_{2}$,不同条件下发生上述反应。实验测得平衡时$\rm CH_{3}OH$的物质的量$(n)$随温度$(T)$、压强$(p)$的变化如图$\rm 1$所示。
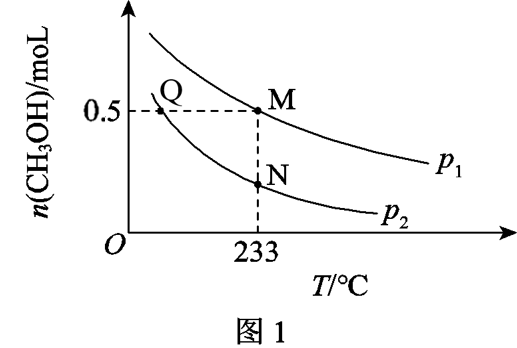
①$p_{1}$ $p_{2}($填“$\rm \lt $”或“$\rm \gt $”$\rm )$。
②$\rm M$点对应的平衡混合气体的体积为$\rm 2\;\rm L$,则$\rm M$点$\rm H_{2}$的转化率为 $\rm ($用最简分数表示$\rm )$,$\rm 233\;\rm ^\circ\rm C$时$(1)$制甲醇方程式对应的平衡常数$ K=$ $\rm ($单位略$\rm )$。
③下列叙述正确的是 $\rm ($填字母$\rm )$。
$\rm a$.$\rm M$、$\rm N$点的平衡常数一定相等
$\rm b$.$\rm Q$、$\rm M$点的容器体积一定相等
$\rm c$.$\rm Q$、$\rm N$点的$\rm H_{2}$的转化率一定相等
$\rm d$.密闭容器的体积不再改变时体系一定达到平衡状态
$\\gt $ ;$\\dfrac{1}{3}$; $16$ ;$\\rm abd$
"]]①反应$\rm CO\left( \text{g} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons C{{H}_{3}}OH\left( \text{g} \right)$,该反应正方向气体分子数减小,增大压强,平衡正向进行,平衡时$\rm C{{H}_{3}}OH$的物质的量较大,由图可知,${{{p}}_{1}}\gt {{{p}}_{2}}$。
②$\rm M$点对应的平衡混合气体中,甲醇有$0.5\;\rm mol$,列出三段式计算:$\rm \begin{matrix} {} &\rm CO\left( \text{g} \right) & +2{{\text{H}}_{2}}\left( \text{g} \right) & \rightleftharpoons &\rm C{{H}_{3}}OH\left( \text{g} \right) & {} \\开始量 \left(\rm mol \right) & 1 & 1.5 & {} & 0 & {} \\反应量\left(\rm mol \right) & 0.5 & 1.0 & {} & 0.5 & {} \\ 剩余量\left( \rm mol \right) & 0.5 & 0.5 & {} & 0.5 & {} \\ \end{matrix}$,此时,$\rm {{\text{H}}_{2}}$的转化率为$\dfrac{1.0\;\rm mol}{1.5\;\rm mol}=\dfrac{1}{3}$。$233$时制甲醇方程式对应的平衡常数${K}=\dfrac{\left( \dfrac{0.5}{2} \right)}{\left( \dfrac{0.5}{2} \right)\times {{\left( \dfrac{0.5}{2} \right)}^{2}}}=16$。
③$\rm a$.$\rm M$、$\rm N$点的温度相同,所以平衡常数一定相等,$\rm a$正确;
$\rm b$.$\rm Q$、$\rm M$点压强和温度均不相同,但是平衡时甲醇含量相同,并且起始量也相同,说明剩余各气体的含量均一样,二者平衡效果相同,故容器体积一定相等,$\rm b$正确;
$\rm c$.$\rm Q$、$\rm N$点是在相同压强下,温度不同情况下的反应,升高温度,合成甲醇的反应逆向移动,$\rm H_{2}$的转化率不同,$\rm c$错误;
$\rm d$.由于合成甲醇的反应不是等体积反应,未平衡时,容器体积发生变化,当密闭容器的体积不再改变时,说明达到平衡状态,$\rm d$正确;
答案选$\rm abd$。
工业上可利用甲醇羰基化法进一步制取甲酸甲酯:$\rm CH_{3}OH(g)+CO(g)\rightleftharpoons \rm HCOOCH_{3}(g)$。在容积不变的密闭容器中,投入等物质的量的$\rm CH_{3}OH$和$\rm CO$,相同时间内$\rm CO$的转化率随温度变化如图$\rm 2$所示$\rm ($不考虑其他副反应及催化剂失活因素$\rm )$。
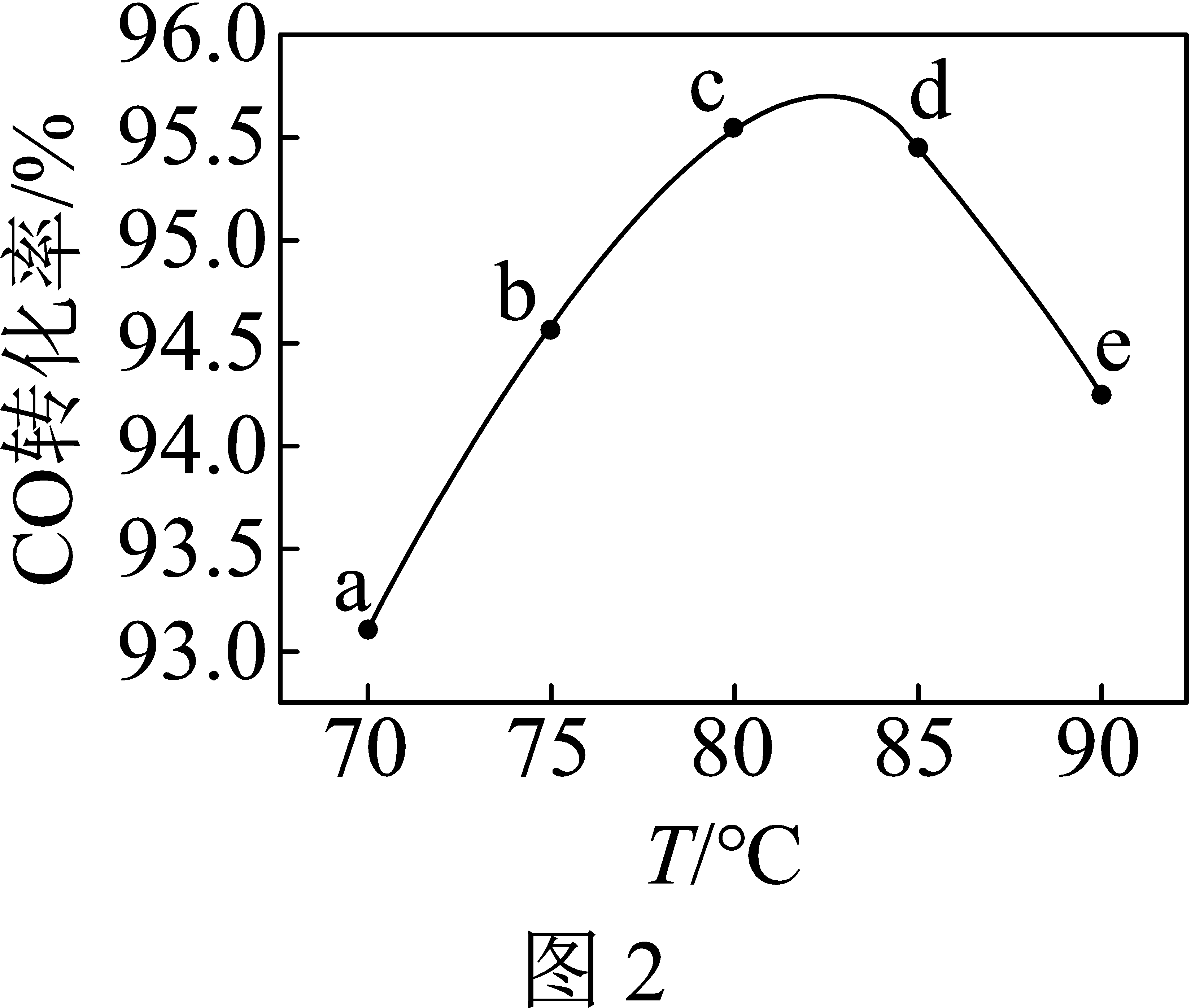
①该反应是 $\rm ($填“放热”或“吸热”$\rm )$反应。
②曲线$\rm ac$段呈上升趋势,$\rm de$段呈下降趋势。试从反应速率和平衡角度说明理由: 。
放热; $\\rm ac$段,反应未达平衡,温度升高,反应速率增大;$\\rm de$段,已经达到平衡,升高温度使平衡向逆反应方向移动,$\\rm CO$转化率降低
"]]由图可知,$\rm ac$段,反应未达平衡,温度升高,反应速率增大,相同时间内消耗$\rm CO$多;$\rm de$段,已经达到平衡,升高温度使平衡向逆反应方向移动,$\rm CO$转化率降低,说明该反应是放热反应。故曲线$\rm ac$段和$\rm de$段的变化趋势不同。
高中 | 化学平衡常数题目答案及解析(完整版)
