高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
二氯亚砜$\rm (\text{SOC}{{\text{l}}_{2}}\rm )$是重要的液态化工原料。回答下列问题:
合成$\text{SOC}{{\text{l}}_{2}}$前先制备$\text{SC}{{\text{l}}_{2}}$。有关转化关系为:
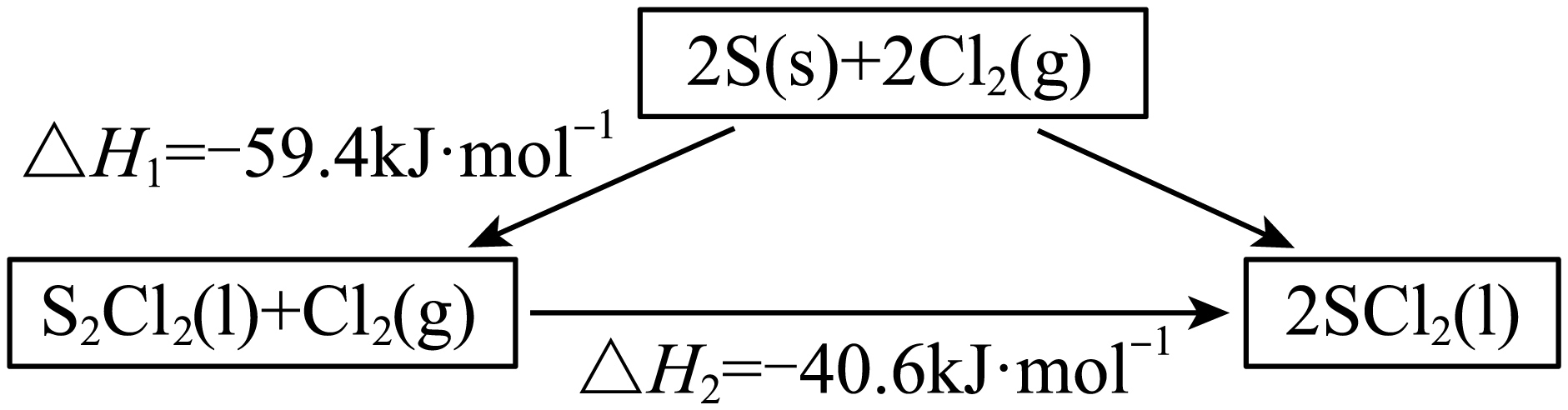
则$\text{S}\left( \text{s} \right)+\text{C}{{\text{l}}_{2}}\left( \text{g} \right)=\text{SC}{{\text{l}}_{2}}\left( 1 \right)$的$\Delta {{H}_{3}}=$ $\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。
$\\rm -50$
"]]由盖斯定律可知,$\text{2S}\left( \text{s} \right)+2\text{C}{{\text{l}}_{2}}\left( \text{g} \right)=2\text{SC}{{\text{l}}_{2}}\left( 1 \right)$的焓变为$\Delta {{H}_{1}}+\Delta {{H}_{2}}=\left( \text{-59}{.4 kJ/mol} \right)+\left( \text{-40}{.6 kJ/mol} \right)\text{=-100 kJ/mol}$,则$\text{S}\left( \text{s} \right)+\text{C}{{\text{l}}_{2}}\left( \text{g} \right)=\text{SC}{{\text{l}}_{2}}\left( 1 \right)$的$\Delta {{H}_{3}}=\dfrac{1}{2}\times \left( \text{-100 kJ/mol} \right)\text{=-50 kJ/mol}$;
密闭容器中,以活性炭为催化剂,由$\text{SC}{{\text{l}}_{2}}$和${{\text{O}}_{2}}$制备$\text{SOC}{{\text{l}}_{2}}$。反应如下:
Ⅰ $\text{SC}{{\text{l}}_{2}}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)=\text{S}{{\text{O}}_{2}}\text{C}{{\text{l}}_{2}}\left( \text{g} \right)$
Ⅱ $\text{SC}{{\text{l}}_{2}}\left( \text{g} \right)+\text{S}{{\text{O}}_{2}}\text{C}{{\text{l}}_{2}}\left( \text{g} \right)\rightleftharpoons 2\text{SOC}{{\text{l}}_{2}}(\text{g})$
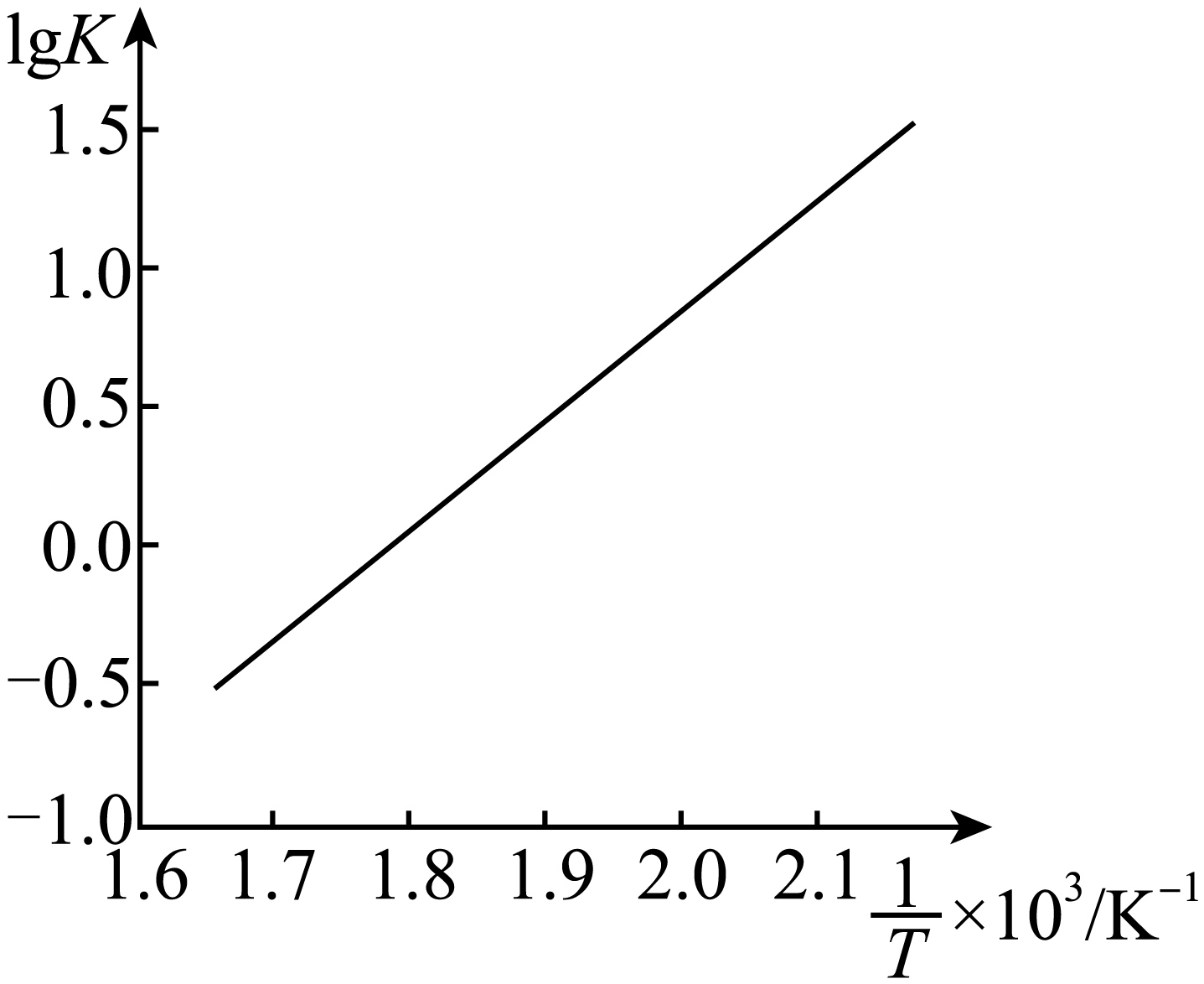
①反应Ⅱ的$\lg K (K$为平衡常数$ )$随$\dfrac{1}{T} (T$为温度$ )$的变化如图,推断出该反应为 $\rm ($填“吸热”或“放热”$\rm )$反应。
②$\rm 466$ $\rm K$时,平衡体系内各组分的物质的是分数$x\left( \text{A} \right)$随$\dfrac{n\left( \text{SC}{{\text{l}}_{2}} \right)}{n\left( {{\text{O}}_{2}} \right)}$的变化如图。
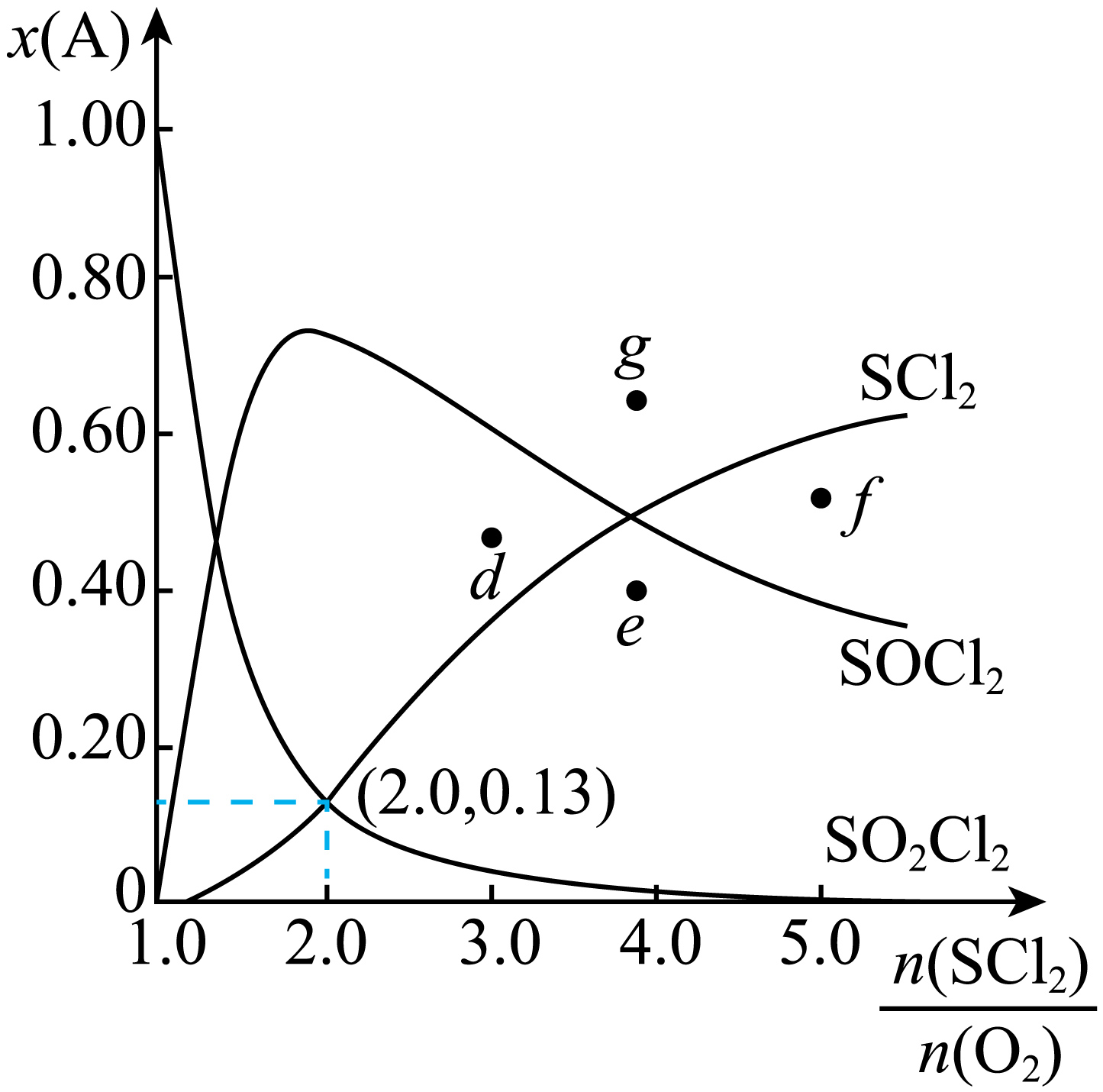
反应Ⅱ的平衡常数${{K}_{1}}=$ $\rm ($保留$\rm 1$位小数$\rm )$。保持$T$和$\dfrac{n\left( \text{SC}{{\text{l}}_{2}} \right)}{n\left( {{\text{O}}_{2}} \right)}$不变,增大$\text{SC}{{\text{l}}_{2}}$平衡转化率的措施有 $\rm ($任举一例$\rm )$。
③改变$T$,使反应Ⅱ的平衡常数${{K}_{2}}=\dfrac{1}{8}{{K}_{1}}$,导致图中的曲线变化,则$x\left( \text{SC}{{\text{l}}_{2}} \right)$等于$x\left( \text{SOC}{{\text{l}}_{2}} \right)$的新交点将出现在 $\rm ($填“$\text{d}$”“$\text{e}$”“$\text{f}$”或“$\text{g}$”$\rm )$处。
放热 ; $\\rm 32.4$ ; 移走$\\text{SOC}{{\\text{l}}_{2}}$或加入$\\rm SO_{2}Cl_{2}$ ; $\\rm d$
"]]①由图可知反应Ⅱ的$\lg K$与$\dfrac{1}{T}$成正比,则温度升高即$\dfrac{1}{T}$减小随之$\lg K$减小,那么$K$值减小,平衡逆向移动,反应Ⅱ为放热反应;
②由图可知,$\dfrac{n\left( \text{SC}{{\text{l}}_{2}} \right)}{n\left( {{\text{O}}_{2}} \right)}\rm =2.0$时,平衡体系物质的量分数$x\left( \text{SC}{{\text{l}}_{\text{2}}} \right)=x\left( \text{S}{{\text{O}}_{\text{2}}}\text{C}{{\text{l}}_{\text{2}}} \right)=0.13$,由于$\text{SC}{{\text{l}}_{2}}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)=\text{S}{{\text{O}}_{2}}\text{C}{{\text{l}}_{2}}\left( \text{g} \right)$为非可逆反应,故$\rm O_{2}$应完全转化,即平衡体系中不存在$\rm O_{2}$,则$x\left( \text{SOC}{{\text{l}}_{\text{2}}} \right)=1-x\left( \text{SC}{{\text{l}}_{\text{2}}} \right)-x\left( \text{S}{{\text{O}}_{\text{2}}}\text{C}{{\text{l}}_{\text{2}}} \right)=0.74$,反应Ⅱ$\text{SC}{{\text{l}}_{2}}\left( \text{g} \right)+\text{S}{{\text{O}}_{2}}\text{C}{{\text{l}}_{2}}\left( \text{g} \right)\rightleftharpoons 2\text{SOC}{{\text{l}}_{2}}(\text{g})$是气体体积不变的反应,则平衡常数可用物质的量分数代替计算,反应Ⅱ的平衡常数${{K}_{1}}=\dfrac{{{0.74}^{2}}}{0.13\times 0.13}=32.4$;保持$T$和$\dfrac{n\left( \text{SC}{{\text{l}}_{2}} \right)}{n\left( {{\text{O}}_{2}} \right)}$不变,减小生成物浓度或加入其他反应物均能使平衡正移,增大$\text{SC}{{\text{l}}_{2}}$平衡转化率的措施有移走$\text{SOC}{{\text{l}}_{2}}$或加入$\rm SO_{2}Cl_{2}$;
③反应Ⅱ为放热反应,改变$T$,使反应Ⅱ的平衡常数${{K}_{2}}=\dfrac{1}{8}{{K}_{1}}$,其平衡常数减小,则为升高温度,反应Ⅱ逆向移动,使得$\text{SOC}{{\text{l}}_{2}}$含量减小、$\text{SC}{{\text{l}}_{2}}$增加,则图中$x\left( \text{SC}{{\text{l}}_{2}} \right)$等于$x\left( \text{SOC}{{\text{l}}_{2}} \right)$的新交点将会提前,出现在$\rm d$处;
我国科研人员在含$\text{L}{{\text{i}}^{+}}$的$\text{SOC}{{\text{l}}_{2}}$溶液中加入${{\text{I}}_{2}}$,提高了$\text{Li}-\text{SOC}{{\text{l}}_{2}}$电池的性能。该电池放电时,正极的物质转变步骤如图。其中,${{\text{I}}_{2}}$的作用是 ;正极的电极反应式为 。
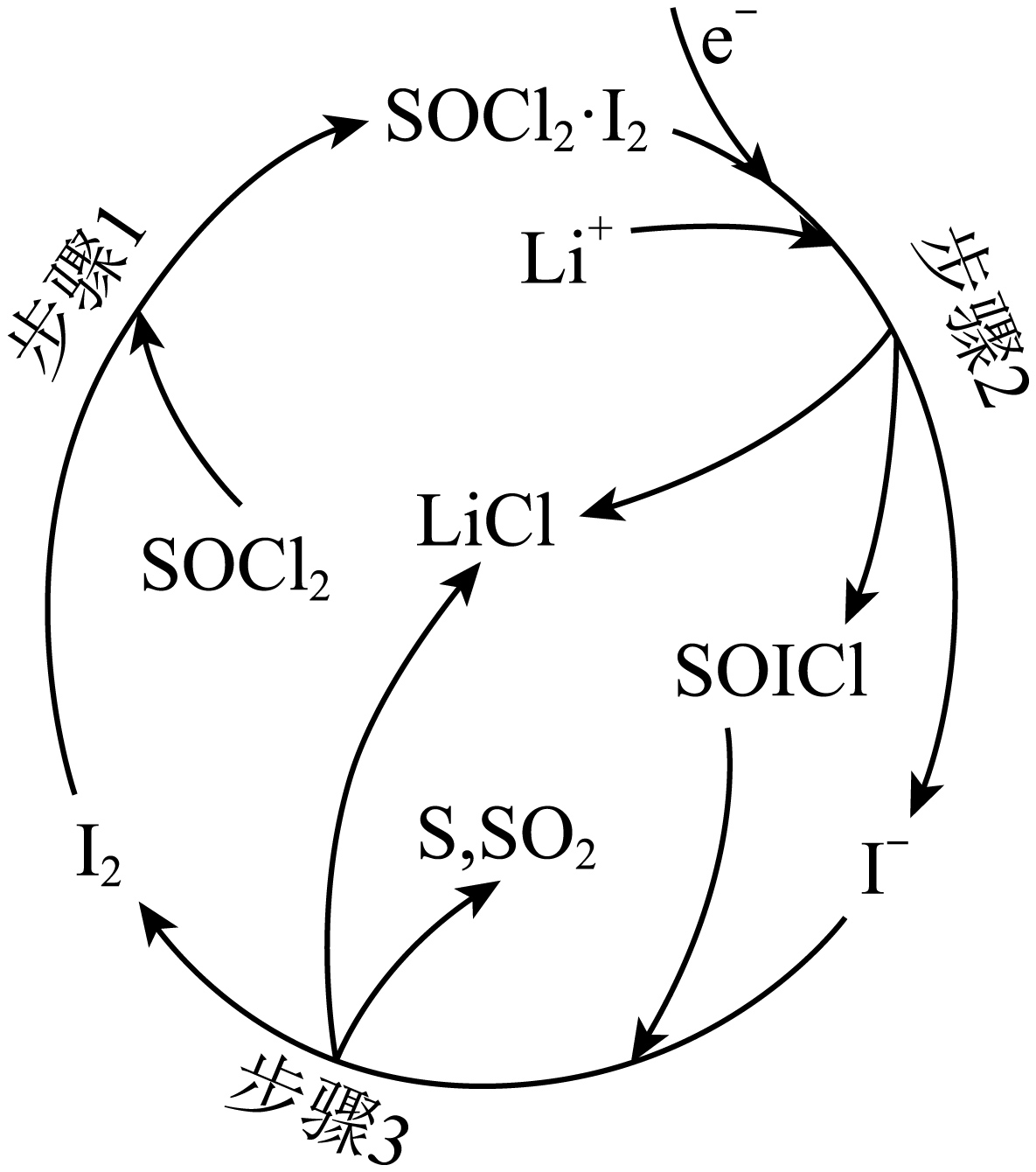
催化作用 ; $\\rm {2SOC}{{{l}}_{{2}}}{+4\\;\\rm L}{{{i}}^{+}}{+4}{{\\text{e}}^{-}}\\begin{matrix} \\underline{\\underline{{{\\text{I}}_{\\text{2}}}}} \\\\ {} \\\\ \\end{matrix}\\text{S+S}{{\\text{O}}_{\\text{2}}}{+4\\rm LiCl}$
"]]由图可知,${{\text{I}}_{2}}$在反应中被消耗又生成,作用是催化作用;放电时,正极上$\text{SOC}{{\text{l}}_{2}}$得到电子发生还原转化为$\rm S$、$\rm SO_{2}$,正极电极反应为: $\rm {2SOC}{{{l}}_{{2}}}{+4\;\rm L}{{{i}}^{+}}{+4}{{\text{e}}^{-}}\begin{matrix} \underline{\underline{{{\text{I}}_{\text{2}}}}} \\ {} \\ \end{matrix}\text{S+S}{{\text{O}}_{\text{2}}}{+4\rm LiCl}$。
高中 | 化学平衡常数题目答案及解析(完整版)
