高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
物质的性质决定着反应的多样性。对于$\text{A}{{\text{g}}^{+}}$与$\mathrm{I}^{-}$的反应,$\rm Z$同学就有着不同想法。为此,他设计了以下实验:
研究$\text{AgN}{{\text{O}}_{3}}$溶液与$\rm KI$溶液反应
实验Ⅰ:向盛有$\rm 1\;\rm mL\;\rm 1\;\rm mol/L\;\text{AgN}{{\text{O}}_{3}}$溶液的试管中加入$\rm 1\;\rm mL\;\rm 1\;\rm mol/L\;\rm KI$溶液,振荡试管,静置。取上层清液,向其中加入 ,溶液无明显变化。
结论Ⅰ:二者混合只发生沉淀反应,无明显氧化还原反应。
淀粉溶液
"]]向盛有$\rm 1\;\rm mL\;\rm 1\;\rm mol/L\;AgNO_{3}$溶液的试管中加入$\rm 1\;\rm mL\;\rm 1\;\rm mol/L\;KI$溶液,振荡试管,静置,取上层清液,向其中加入淀粉溶液,溶液无明显变化,则二者混合只发生沉淀反应,无明显氧化还原反应。
探究$\text{A}{{\text{g}}^{+}}$的氧化性强弱
实验Ⅱ:将打磨光亮的铁丝伸入$\rm 1\; mol/L\;\text{AgN}{{\text{O}}_{3}}$溶液中,一段时间后将铁丝取出。除去溶液中剩余的$\text{A}{{\text{g}}^{+}}$,取$\rm 1\sim 2\; mL$溶液于试管中,加入试剂$\rm X$,振荡,溶液变为红色,证明溶液中存在$\text{F}{{\text{e}}^{3+}}$。试剂$\rm X$应为 。
结论Ⅱ: 。
$\\rm KSCN$溶液;银离子具有强氧化性,和铁反应生成铁离子
"]]将打磨光亮的铁丝伸入$\rm 1\;\rm mol/L\;AgNO_{3}$溶液中,一段时间后将铁丝取出,除去溶液中剩余的$\rm Ag^{+}$,取$\rm 1\sim 2\;\rm mL$溶液于试管中,加入试剂$\rm KSCN$溶液,振荡,溶液变为红色,证明溶液中存在$\rm Fe^{3+}$,则试剂$\rm X$应为$\rm KSCN$溶液,得到结论Ⅱ:银离子具有强氧化性,和铁反应生成铁离子。
已知$\text{F}{{\text{e}}^{3+}}$氧化性大于${{\text{I}}_{2}}$,则证明$\text{A}{{\text{g}}^{+}}$可与$\mathrm{I}^{-}$发生氧化还原反应。
①$\rm X$同学测得常温下该$\text{AgN}{{\text{O}}_{3}}$溶液的$\rm pH$为$\rm 5.5$,于是对结论Ⅱ提出质疑,认为可能是酸性条件下$\text{NO}_{3}^{-}$体现了氧化性。
为了验证其质疑是否正确,他设计了一个对比实验:将打磨光亮的铁丝伸入 溶液中,一段时间后将铁丝取出。取$\rm 1\sim2\;\rm mL$溶液于试管中,加入试剂$\rm X$,观察溶液是否呈红色。
②同时,$\rm X$同学考虑到$\text{AgN}{{\text{O}}_{3}}$溶液与$\rm KI$溶液反应体系中存在竞争反应。所以,他设计了以下实验来探究$\text{A}{{\text{g}}^{+}}$与$\mathrm{I}^{-}$的氧化还原反应
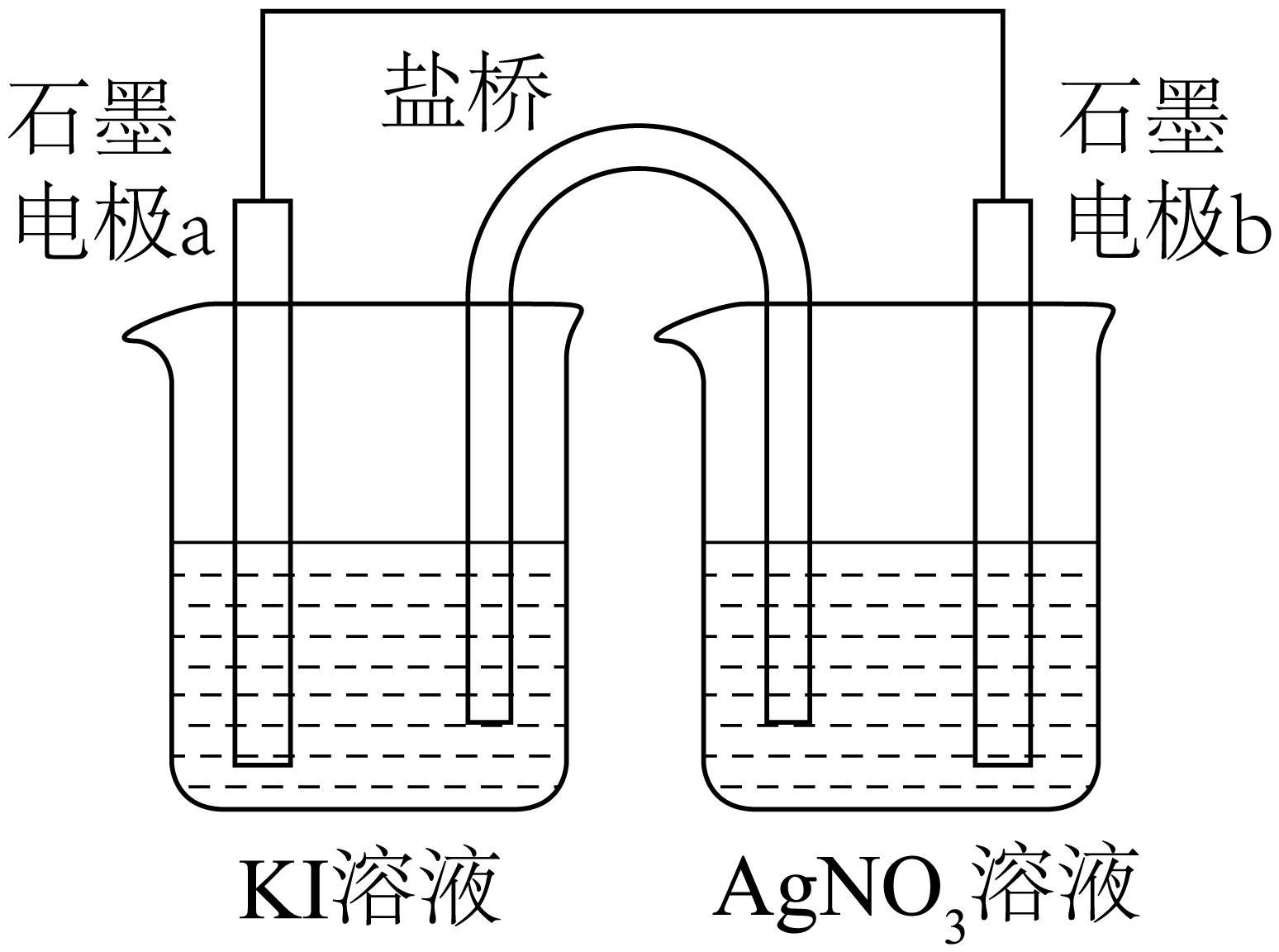
根据此装置,盐桥中可选择 作为电解质。
$\rm a$.$\rm KCl$ $\rm b$.$\rm \text{KN}{{\text{O}}_{3}}$ $\rm c$.$\rm {{\text{K}}_{2}}\text{S}{{\text{O}}_{4}}$
在此实验中,可通过 $\rm ($填实验现象$\rm )$证明$\rm \text{A}{{\text{g}}^{+}}$与$\rm \mathrm{I}^{-}$一定发生了氧化还原反应。
$\\rm NaNO_{3}$;$\\rm b$;电极$\\rm b$上析出金属银,电极$\\rm a$附近溶液变紫红色
"]]①为验证是否为银离子氧化铁生成铁离子的主要原因,将打磨光亮的铁丝伸入$\rm NaNO_{3}$溶液中,一段时间后将铁丝取出,取$\rm 1\sim 2\;\rm mL$溶液于试管中,加入试剂$\rm X$,观察溶液若不呈红色,这样$\rm \text{NO}_{3}^{-}$离子浓度保持不变,就可以进行比较得到结论Ⅱ正确;
②$\rm X$同学考虑到$\rm AgNO_{3}$溶液与$\rm KI$溶液反应体系中存在竞争反应,设计了实验来探究$\rm Ag^{+}$与$\rm I^{- }$的氧化还原反应,盐桥中可选择$\rm KNO_{3}$溶液,氯化钾中氯离子会结合银离子生成沉淀,硫酸钾溶液中硫酸根离子也会结合银离子形成沉淀,会干扰实验,在此实验中,电极$\rm a$为原电池的负极,电极反应:$\rm 2I^{- }-2e^{- }=I_{2}$,电极$\rm b$为原电池的正极,电极反应:$\rm Ag^{+}+e^{- }=Ag$,可通过电极$\rm b$上析出金属银,电极$\rm a$附近溶液变紫红色现象,证明$\rm Ag^{+}$与$\rm I^{- }$一定发生了氧化还原反应。
$\rm X$同学查阅资料,得知常温下,$\text{A}{{\text{g}}^{+}}+{{\text{I}}^{-}}=\text{AgI}\qquad{{K}_{1}}=1.17\times {{10}^{16}}$、$2\text{A}{{\text{g}}^{+}}+2{{\text{I}}^{-}}={{\text{I}}_{2}}+2\text{Ag}\qquad{{K}_{2}}=3\times {{10}^{8}}$,试从速率和平衡两个方面解释$\text{AgN}{{\text{O}}_{3}}$溶液与$\rm KI$溶液混合只发生沉淀反应而无明显氧化还原反应的可能原因: 。
$\\rm Ag^{+}$与$\\rm I^{- }$生成沉淀反应的平衡常数远比氧化还原反应的平衡常数大,$\\rm Ag^{+}$与$\\rm I^{- }$生成沉淀反应的反应速率远比氧化还原反应的反应速率大
"]]从所给的数据可知,两种溶液混合时,$\rm Ag^{+}$与$\rm I^{- }$生成沉淀反应的平衡常数远比氧化还原反应的平衡常数大,且$\rm Ag^{+}$与$\rm I^{- }$生成沉淀反应的反应速率远比氧化还原反应的反应速率大。
高中 | 化学平衡常数题目答案及解析(完整版)
