高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
利用页岩气中丰富的丙烷制丙烯已成为化工原料丙烯生产的重要渠道。
Ⅰ.丙烷直接脱氢法:${\rm {{C}_{3}}{{H}_{8}}(g)\rightleftharpoons {{C}_{3}}{{H}_{6}}(g)+{{H}_{2}}(g)}\quad\Delta {{H}_{1}}=+124\rm \ kJ\cdot mo{{l}^{-1}}$
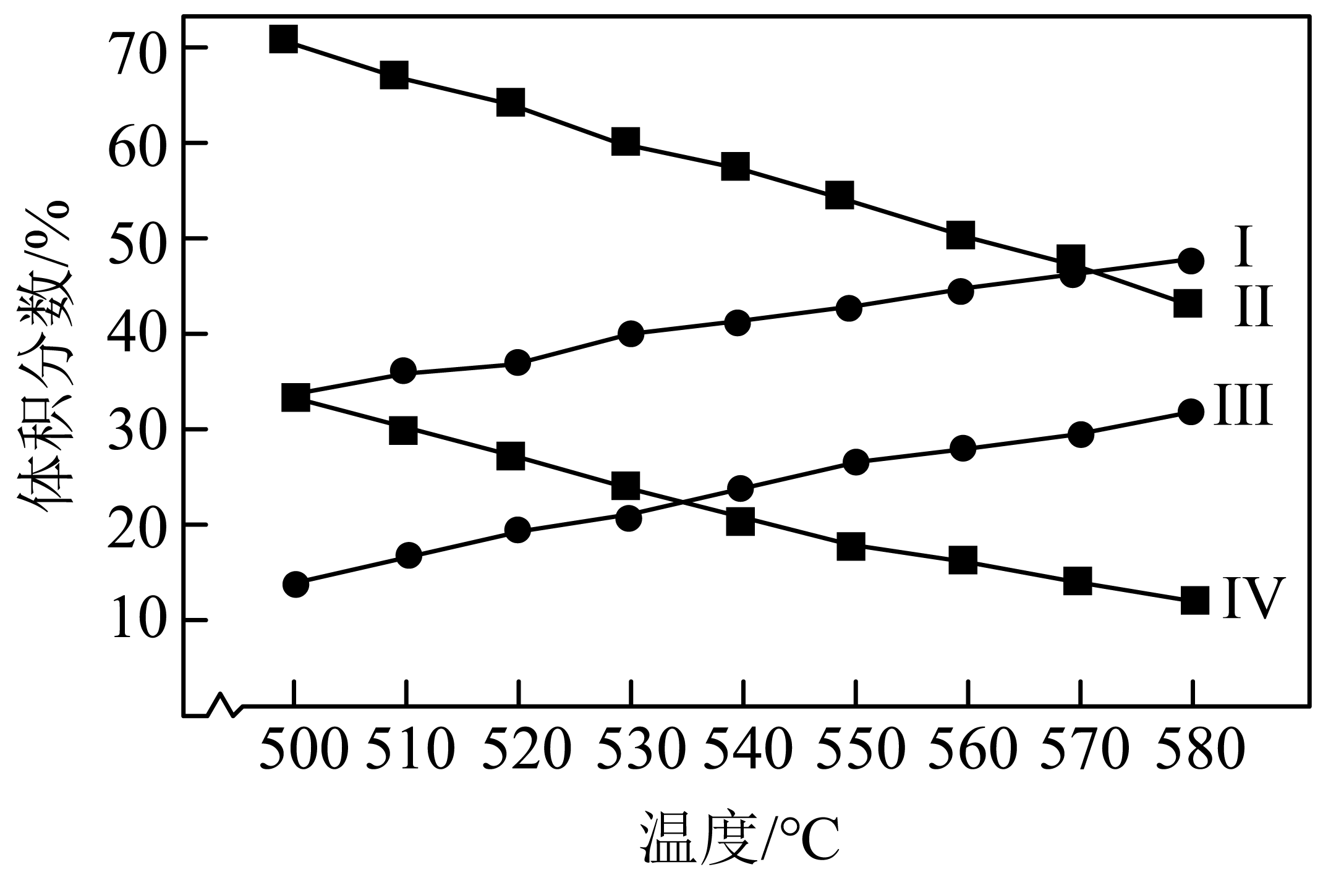
总压分别为$\rm 100\ kPa$、$\rm 10\ kPa$时发生该反应,平衡体系中$\rm {{C}_{3}}{{H}_{8}}$和$\rm {{C}_{3}}{{H}_{6}}$的体积分数随温度、压强的变化如下图。
丙烷直接脱氢反应的化学平衡常数表达式为$K=$ 。
$\\dfrac{{{c}_{\\rm ({{C}_{3}}{{H}_{6}})}}{{c}_{\\rm ({{H}_{2}})}}}{{{c}_{\\rm ({{C}_{3}}{{H}_{8}})}}}$
"]]根据反应方程式$\rm {{C}_{3}}{{H}_{8}}(g)\rightleftharpoons {{C}_{3}}{{H}_{6}}(g)+{{H}_{2}}(g)$可知,丙烷直接脱氢反应的化学平衡常数表达式为$K=\dfrac{{{c}_{\rm ({{C}_{3}}{{H}_{6}})}}{{c}_{({{\rm H}_{2}})}}}{{{c}_{\rm ({{C}_{3}}{{H}_{8}})}}}$。
总压由$\rm 10\ kPa$变为$\rm 100\ kPa$时,化学平衡常数 $\rm ($填“变大”“变小”或“不变”$\rm )$。
不变
"]]已知化学平衡常数仅仅是温度的函数,故总压由$\rm 10\ kPa$变为$\rm 100\ kPa$时,由于温度不变,化学平衡常数不变。
图中,曲线Ⅰ、Ⅲ表示$\rm {{C}_{3}}{{H}_{6}}$的体积分数随温度的变化,判断依据是 。
丙烷直接脱氢反应的正反应是一个吸热反应,升高温度化学平衡正向移动,$\\rm C_{3}H_{6}$的体积分数随温度升高而增大
"]]由题干可知,$\rm {{C}_{3}}{{H}_{8}}(g)\rightleftharpoons {{C}_{3}}{{H}_{6}}(g)+{{H}_{2}}(g)$正反应是一个吸热反应,升高温度化学平衡正向移动,$\rm C_{3}H_{6}$的体积分数随温度升高而增大,故图中,曲线Ⅰ、Ⅲ表示$\rm C_{3}H_{6}$的体积分数随温度的变化。
图中,表示$\rm 100\ kPa$时$\rm {{C}_{3}}{{H}_{8}}$的体积分数随温度变化的曲线是 $\rm ($填“Ⅱ”或“Ⅳ”$\rm )$。
Ⅱ
"]]由题干可知,$\rm {{C}_{3}}{{H}_{8}}(g)\rightleftharpoons {{C}_{3}}{{H}_{6}}(g)+{{H}_{2}}(g)$正反应是气体体积增大的方向,故增大压强上述平衡逆向移动,则有温度相同时,压强越大,$\rm C_{3}H_{8}$的体积分数也越大,则图中表示$\rm 100\ kPa$时$\rm C_{3}H_{8}$的体积分数随温度变化的曲线是Ⅱ。
Ⅱ.丙烷氧化脱氢法:
${\rm {{C}_{3}}{{H}_{8}}(g)+\dfrac{1}{2}{{O}_{2}}(g)\rightleftharpoons {{C}_{3}}{{H}_{6}}(g)+{{H}_{2}}O(g)}\quad\Delta {{H}_{2}}=-101\rm \ kJ\cdot mo{{l}^{-1}}$
我国科学家制备了一种新型高效催化剂用于丙烷氧化脱氢。在催化剂作用下,相同时间内,不同温度下的转化率和$\rm C_{3}H_{6}$的产率如下:
| 反应温度$\rm /^\circ \text{C}$ | $\rm 465$ | $\rm 480$ | $\rm 495$ | $\rm 510$ |
| $\rm C_{3}H_{8}$的转化率$\rm /\%$ | $\rm 5.5$ | $\rm 12.1$ | $\rm 17.3$ | $\rm 28.4$ |
| $\rm C_{3}H_{6}$的产率$\rm /\%$ | $\rm 4.7$ | $\rm 9.5$ | $\rm 12.8$ | $\rm 18.5$ |
表中,$\rm C_{3}H_{8}$的转化率随温度升高而上升的原因是 $\rm ($答出$\rm 1$点即可$\rm )$。
温度越高,反应速率越快,相同时间内反应掉的$\\rm C_{3}H_{8}$越大,故$\\rm C_{3}H_{8}$的转化率越大
"]]达到化学平衡之前,温度越高,反应速率越快,相同时间内反应掉的$\rm C_{3}H_{8}$越大,故$\rm C_{3}H_{8}$的转化率越大。
已知:$\rm C_{3}H_{6}$选择性$=\dfrac{生成丙烯消耗丙烷的物质的量}{消耗丙烷的总物质的量}\times 100\%$。随着温度升高,$\rm C_{3}H_{6}$的选择性 $\rm ($填“升高”“降低”或“不变”$\rm )$,可能的原因是 。
降低;升高温度,更有利于副反应的发生
"]]由表中信息可知$\rm 465\ ^\circ \text{C}$时丙烯的选择性约为$\rm 85\%$,$\rm 510\ ^\circ \text{C}$时为约$\rm 65\%$,故随着温度升高,$\rm C_{3}H_{6}$的选择性降低,因为可能为:升高温度,更有利于副反应的发生。
高中 | 化学平衡常数题目答案及解析(完整版)
