高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
$\text{C}{{\text{O}}_{2}}$的资源化利用是实现“碳中和、碳达峰”的途径。$\text{C}{{\text{O}}_{2}}$合成甲醇的过程中涉及如下反应:
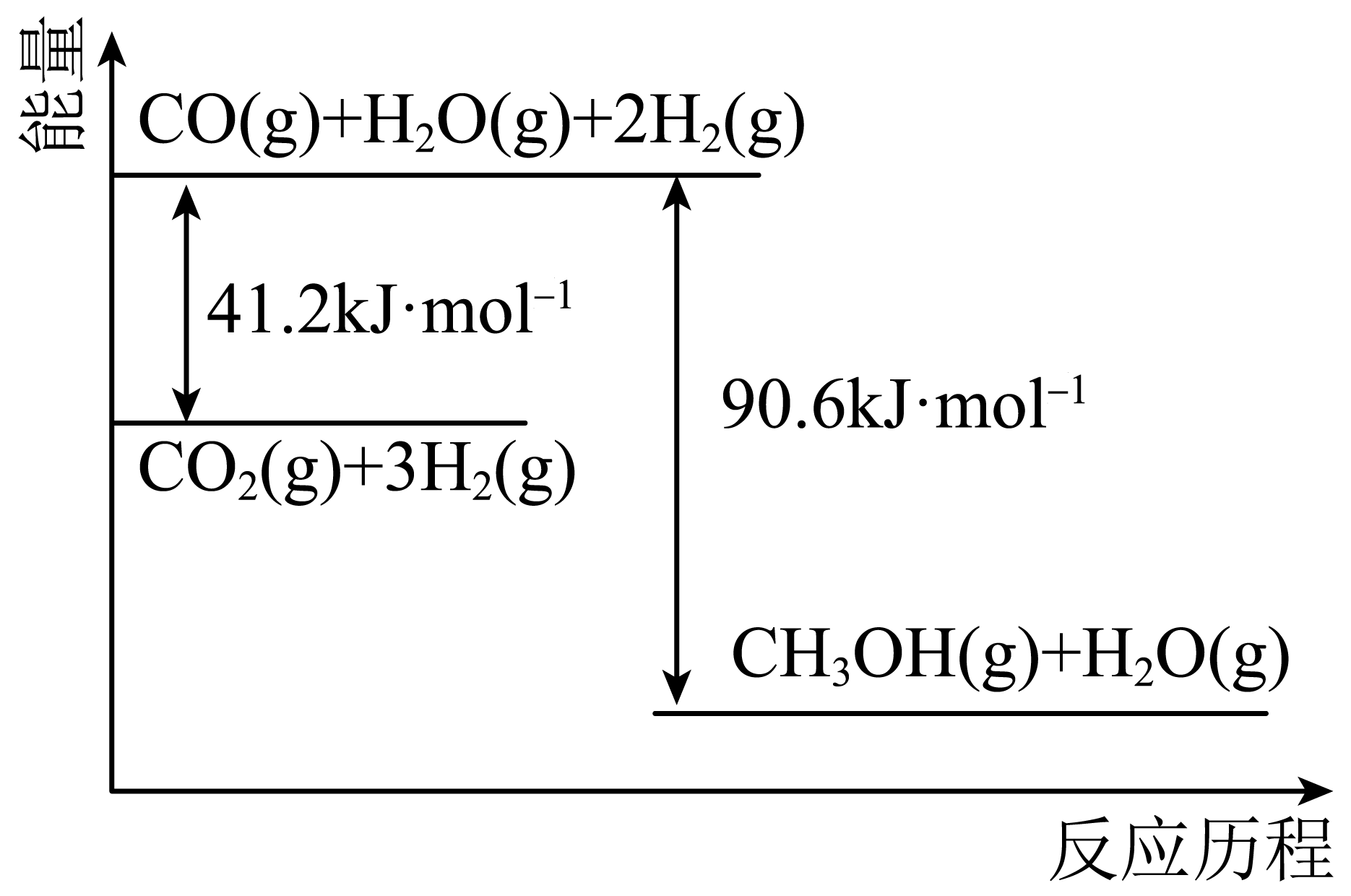
反应ⅰ. $\text{C}{{\text{O}}_{2}}\left( \text{g} \right)+3{{\text{H}}_{2}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{\text{1}}}$ ;
反应副反应ⅱ. 副反应。
回答下列问题。
①根据图,$\Delta {{H}_{\text{1}}}=$ $\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{1}}$。
②原料发生副反应会生成$\text{CO}$等气体产物,已知每生成$\rm 1$ $\rm mol$ $\text{CO}$吸收热量$\rm 41.2$ $\rm kJ$。写出副反应的热化学方程式 。
$\\rm -49.4$ ; $\\text{C}{{\\text{O}}_{\\text{2}}}\\left( \\text{g} \\right)+{{\\text{H}}_{\\text{2}}}\\left( \\text{g} \\right)\\rightleftharpoons \\text{CO}\\left( \\text{g} \\right)+{{\\text{H}}_{\\text{2}}}\\text{O}\\left( \\text{g} \\right)\\quad \\Delta H=+\\text{41}\\text{.2}\\,\\text{kJ}\\cdot \\text{mo}{{\\text{l}}^{\\text{-1}}}^{-1}$
"]]①根据图示可知,$\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\text{+3}{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{H}}_{\text{3}}}\text{OH}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)$,$\Delta {{H}_{1}}=$反应物总能量$\rm -$生成物的总能量$\rm =41.2$ $\rm kJ/mol-90.6$ $\rm kJ/mol=-49.4$ $\text{kJ}\cdot \text{mo}{{\text{l}}^{1}}$;
②根据题干信息可知,二氧化碳和氢气会发生副反应产生$\rm CO$等气体,则反应为: $\text{C}{{\text{O}}_{\text{2}}}\text{+ }{{\text{H}}_{\text{2}}}\rightleftharpoons \text{CO+}{{\text{H}}_{\text{2}}}\text{O}$,已知每生成$\rm 1\;\rm mol\text{CO}$吸收热量$\rm 41.2\;\rm kJ$,则副反应的热化学方程式为:$\text{C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\left( \text{g} \right)\rightleftharpoons \text{CO}\left( \text{g} \right)+{{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right)\quad \Delta H=+\text{41}\text{.2}\,\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。
$ T^\circ\rm C$时,向$\rm 1\;\rm L$恒容。密闭容器中充入$\rm 1$ $\rm mol$ $\text{C}{{\text{O}}_{2}}$和$\rm 4$ $\rm mol$ ${{\text{H}}_{2}}$发生上述反应。$\rm 10$ $\rm min$末已达到平衡时测得容器中$\text{C}{{\text{O}}_{2}}$的转化率为$\rm 90\%$,$\text{CO}$的物质的量为$\rm 0.3$ $\rm mol$。
①$\rm 0\sim 10$ $\rm min$内,平均反应速率$v\left( \text{C}{{\text{H}}_{\text{3}}}\text{OH} \right)=$ $\text{mol}\cdot {{\text{L}}^{-1}}\cdot \text{mi}{{\text{n}}^{-1}}$。
②$\rm T^\circ\rm C$时,反应ⅱ的 化学平衡常数$K=$ 。
$\\rm 0.06$ ; $\\dfrac{27}{19}$或$\\rm 1.4$
"]]$\rm CO_{2}$的转化率为$\rm 90\%$,则${{n}_{转化}}\left( \text{C}{{\text{O}}_{\text{2}}} \right)=0.9\,\text{mol}$,$\rm CO$的物质的量为$\rm 0.3$ $\rm mol$,则反应ⅱ中${{n}_{转化}}\left( \text{C}{{\text{O}}_{2}} \right)=0.3\,\text{mol}$,则反应ⅰ中${{n}_{转化}}\left( \text{C}{{\text{O}}_{\text{2}}} \right)=0.6\,\text{mol}$,可得:$\begin{matrix} {} \\转化量\text{/mol} \\ \end{matrix}\begin{matrix} \text{C}{{\text{O}}_{\text{2}}}\text{(g)} \\ \text{0}\text{.6} \\ \end{matrix}\begin{matrix} + \\ {} \\ \end{matrix}\begin{matrix} \text{3}{{\text{H}}_{\text{2}}}\text{(g)} \\ 1.8 \\ \end{matrix}\begin{matrix} \rightleftharpoons \\ {} \\ \end{matrix}\begin{matrix} \text{C}{{\text{H}}_{\text{3}}}\text{OH(g)} \\ 0.6 \\ \end{matrix}\begin{matrix} + \\ {} \\ \end{matrix}\begin{matrix} {{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right) \\ 0.6 \\ \end{matrix}$
$\begin{matrix} {} \\ 转化量\text{/mol} \\ \end{matrix}\begin{matrix} \text{C}{{\text{O}}_{\text{2}}}\text{(g)} \\ \text{0}\text{.3} \\ \end{matrix}\begin{matrix} + \\ {} \\ \end{matrix}\begin{matrix} {{\text{H}}_{\text{2}}}\text{(g)} \\ 0.3 \\ \end{matrix}\begin{matrix} \rightleftharpoons \\ {} \\ \end{matrix}\begin{matrix} \text{CO(g)} \\ 0.3 \\ \end{matrix}\begin{matrix} + \\ {} \\ \end{matrix}\begin{matrix} {{\text{H}}_{\text{2}}}\text{O}\left( \text{g} \right) \\ 0.3 \\ \end{matrix}$
故${{n}_{平衡}}\left( \text{C}{{\text{O}}_{\text{2}}} \right)=0.1\,\text{mol}$,${{n}_{平衡}}\left( {{\text{H}}_{\text{2}}} \right)=4\,\text{mol }-1.8\,\text{mol }-0.3\,\text{mol }=1.9\,\text{mol}$,${{n}_{平衡}}\left( \text{C}{{\text{H}}_{\text{3}}}\text{OH} \right)=0.6\,\text{mol}$,${{n}_{平衡}}\left( \text{CO} \right)=0.3\,\text{mol}$,${{n}_{平衡}}\left( {{\text{H}}_{\text{2}}}\text{O} \right)=\text{ }0.3\,\text{mol }+0.6\,\text{mol }=0.9\,\text{mol}$,
①平均反应速率$v\left( \text{C}{{\text{H}}_{\text{3}}}\text{OH} \right)=\dfrac{\Delta c}{\Delta t}=\dfrac{\text{0}\text{.6}\,\text{mol}}{\text{1}\,\text{L }\!\!\times\!\!\text{ 10}\,\text{min}}=0.06\,\text{mol/L}\times {{\min }^{-1}}$;
②反应$\rm ii$的化学平衡常数$K=\dfrac{c(\text{CO})\times c({{\text{H}}_{\text{2}}}\text{O})}{c(\text{C}{{\text{O}}_{\text{2}}}\text{)}\times c(({{\text{H}}_{2}})}=\dfrac{\dfrac{0.3}{1}\times \dfrac{0.9}{1}}{\dfrac{0.1}{1}\times \dfrac{1.9}{1}}=\dfrac{27}{19}\gg 1.4$。
将原料气$n\left( \text{C}{{\text{O}}_{\text{2}}} \right):n\left( {{\text{H}}_{\text{2}}} \right)=1:3$充入某一恒容、密闭容器中,若只发生反应ⅰ,在不同催化剂作用下,反应$t\ \text{min}$时$\text{C}{{\text{O}}_{2}}$的转化率随温度的变化如下图所示。
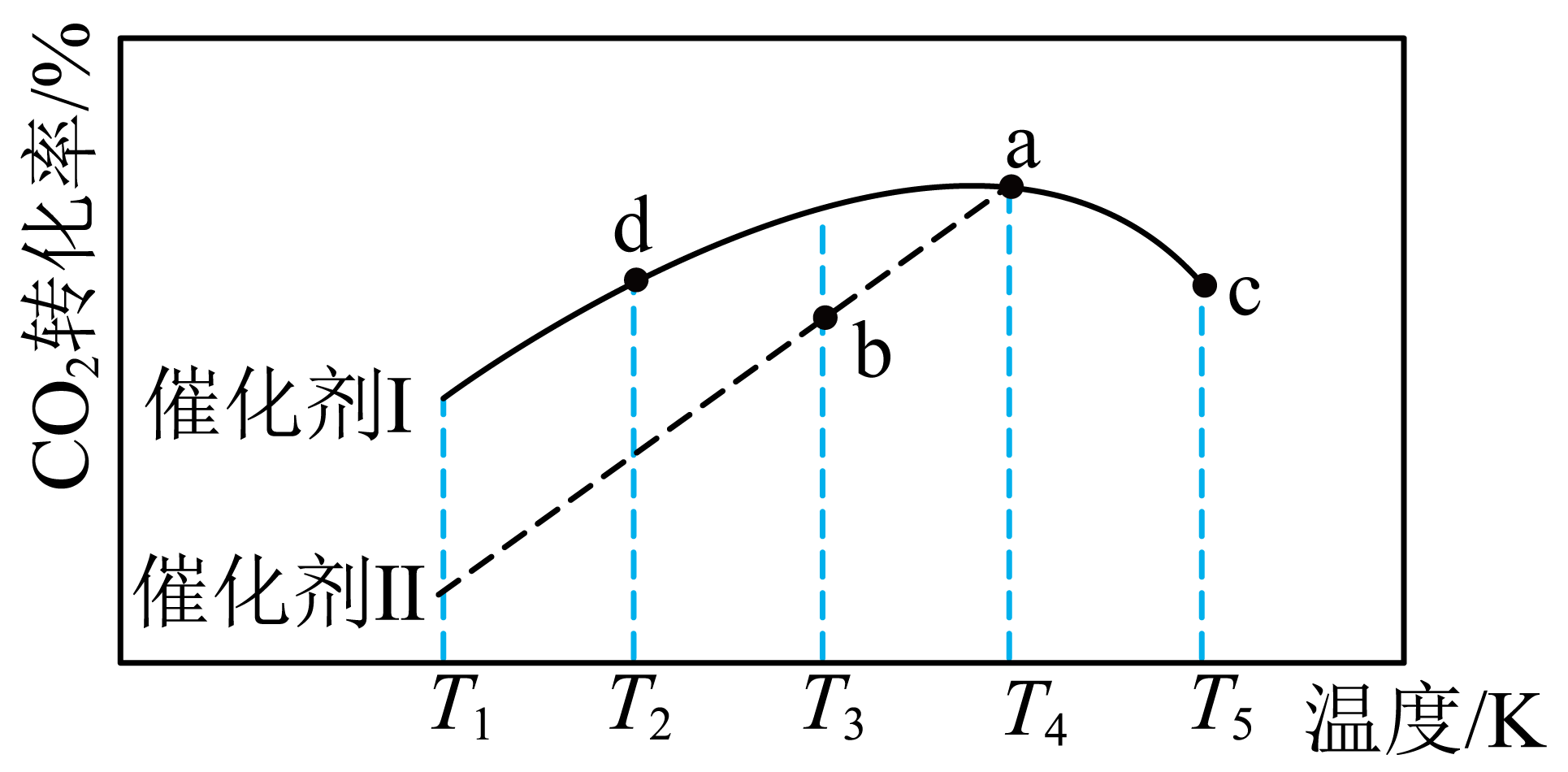
①图中达到化学平衡状态的是 $\rm ($填“$\rm a$”、“$\rm b$”、“$\rm c$”或“$\rm d$”$\rm )$。
②其他条件相同,若将原料气按$n\left( \text{C}{{\text{O}}_{\text{2}}} \right):n\left( {{\text{H}}_{\text{2}}} \right)=1:2.8$充入同一恒容、密闭容器中,在催化剂Ⅰ的作用下发生反应。该条件下,$\rm a$点时$\text{C}{{\text{O}}_{2}}$的转化率 $\rm ($填“增大”或“不变”或“减小”$\rm )$。
$\\rm ac$ ; 减小
"]]①其它条件相同情况下,随温度升高,$\rm CO_{2}$的转化率先增大后降低,说明$\rm CO_{2}$转化率最高点之前未到达平衡,图中达到化学平衡状态的是$\rm ac$;
②若图中$\rm a$点时反应已达平衡,则$\rm d→a$段未到达平衡,该温度下到达平衡时$\rm CO_{2}$转化率高于图中转化率,升高温度平衡逆向移动,温度越高平衡时$\rm CO_{2}$的转化率越低,现原料气按$n\left( \text{C}{{\text{O}}_{\text{2}}} \right):n\left( {{\text{H}}_{\text{2}}} \right)=1:2.8$充入同一恒容密闭容器中,在相同温度到达平衡时$\rm CO_{2}$的转化率降低了。
近日,我国学者研究发现,在单原子$\text{Cu}/\text{Zr}{{\text{O}}_{2}}$催化时,反应ⅰ的历程以及中间体$\text{HCO}{{\text{O}}^{\text{*}}}$与$\text{C}{{\text{H}}_{3}}{{\text{O}}^{\text{*}}}$物质的量之比随时间变化图如下:
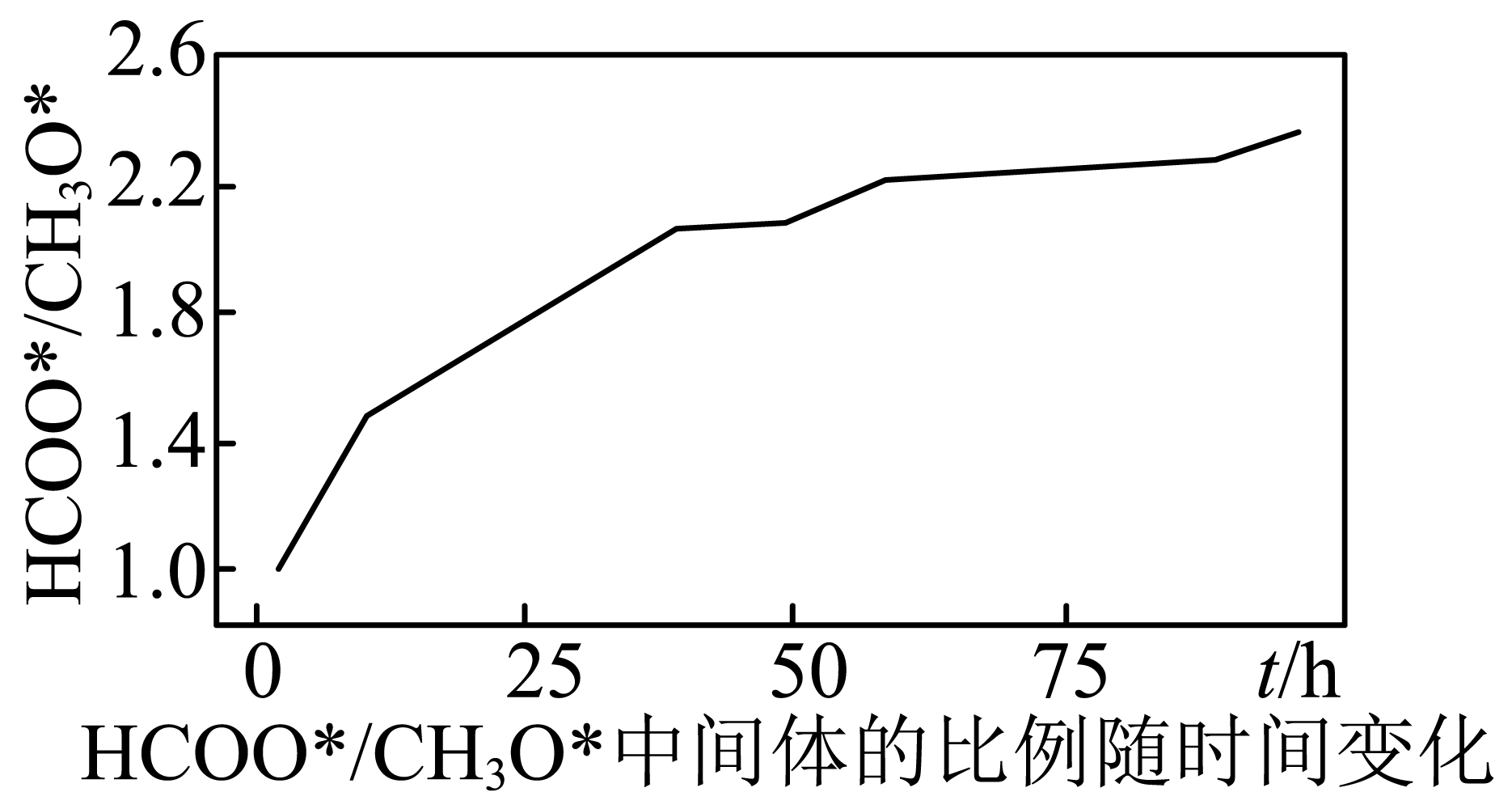
第一步:$\text{C}{{\text{O}}_{2}}+{{\text{H}}_{2}}\to \text{HCO}{{\text{O}}^{\text{*}}}+{{\text{H}}^{\text{*}}}$;
第二步:$\text{HCO}{{\text{O}}^{\text{*}}}+2{{\text{H}}_{2}}\to \text{C}{{\text{H}}_{3}}{{\text{O}}^{\text{*}}}+{{\text{H}}_{2}}\text{O}$;
第三步:$\text{C}{{\text{H}}_{3}}{{\text{O}}^{\text{*}}}+{{\text{H}}^{\text{*}}}\to \text{C}{{\text{H}}_{3}}\text{OH}$。
下列说法不正确的是 $\rm ($填字母序号$\rm )$。
$\rm A$.其他条件相同时,升高温度时,三步反应速率均加快
$\rm B$.用不同催化剂催化反应可以改变反应历程,提高平衡转化率
$\rm C$.反应历程中,第一步反应的活化能最高,是反应的决速步骤
$\\rm B$
"]]$\rm A$.升高温度时,反应速率均加快,故$\rm A$正确;
$\rm B$.用不同催化剂催化反应可以改变反应历程,但不能提高平衡转化率,故$\rm B$错误;
$\rm C$.反应历程中,第二步反应的活化能最高,反应速率最慢,是反应的决速步骤,故$\rm C$正确;
故答案为:$\rm B$。
高中 | 化学平衡常数题目答案及解析(完整版)
