高中 | 盐溶液微粒间的三大守恒原理的理解及应用 题目答案及解析
稿件来源:高途
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐溶液微粒间的三大守恒原理的理解及应用
下表是几种弱电解质的电离平衡常数$\rm (25\;\rm ^\circ\rm C)$
| 电解质 | 电离方程式 | 平衡常数$K$ |
| $\text{C}{{\text{H}}_{3}}\text{COOH}$ | $\text{C}{{\text{H}}_{3}}\text{COOH}\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{CO}{{\text{O}}^{-}}+{{\text{H}}^{+}}$ | $1.76\times {{10}^{-5}}$ |
| ${{\text{H}}_{2}}\text{C}{{\text{O}}_{3}}$ | ${{\text{H}}_{2}}\text{C}{{\text{O}}_{3}}\rightleftharpoons {{\text{H}}^{+}}+\text{HCO}_{3}^{-}$ $\text{HCO}_{3}^{-}\rightleftharpoons {{\text{H}}^{+}}+\text{CO}_{3}^{2-}$ | ${{K}_{1}}=4.31\times {{10}^{-7}}$ ${{K}_{2}}=5.61\times {{10}^{-11}}$ |
| $\text{HA}$ | $\text{HA}\rightleftharpoons {{\text{A}}^{-}}+{{\text{H}}^{+}}$ | $1.1\times {{10}^{-10}}$ |
| ${{\text{H}}_{3}}\text{P}{{\text{O}}_{4}}$ | $\rm {{\text{H}}_{3}}\text{P}{{\text{O}}_{4}}\rightleftharpoons {{\text{H}}^{+}}+{{\text{H}}_{2}}\text{PO}_{4}^{-}$ ${{\text{H}}_{2}}\text{PO}_{4}^{-}\rightleftharpoons {{\text{H}}^{+}}+\text{HPO}_{4}^{2-}$ $\text{HPO}_{4}^{2-}\rightleftharpoons {{\text{H}}^{+}}+\text{PO}_{4}^{3-}$ | ${{K}_{1}}=7.52\times {{10}^{-3}}$ ${{K}_{2}}=6.23\times {{10}^{-8}}$ ${{K}_{3}}=2.20\times {{10}^{-13}}$ |
| $\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O}$ | $\mathrm{NH}_{3} \cdot \mathrm{H}_{2} \mathrm{O} \rightleftharpoons \mathrm{NH}_{4}^{+}+\mathrm{OH}^{-}$ | $1.76\times {{10}^{-5}}$ |
回答下列问题:
由上表分析,若①$\rm CH_{3}COOH$②$\text{HC}{\text{O}}_{3}^{-}$③$\rm HA$④${{\text{H}}_{2}}\text{P}{\text{O}}_{4}^{-}$均可看作酸,则它们酸性由强到弱的顺序为 $\rm ($填序号$\rm )$。
①④③②
"]]酸的电离平衡常数越大,其溶液酸性越强;根据表中数据可知,酸的电离平衡常数大小顺序是①④③②,则它们酸性由强到弱的顺序为①④③②;
试写出$\rm H_{2}CO_{3}$与$\rm NH_{3}·H_{2}O$等物质的量混合所得盐的电离方程式: ;试写出$\rm HA$与$\rm Na_{3}PO_{4}$反应的离子方程式: 。
$\\text{N}{{\\text{H}}_{4}}\\text{HC}{{\\text{O}}_{3}}=\\text{NH}_{4}^{+}+\\text{HCO}_{3}^{-}$ ; $\\text{HA}+\\text{PO}_{4}^{3-}={{\\text{A}}^{-}}+\\text{HPO}_{4}^{2-}$
"]]$\rm H_{2}CO_{3}$与$\rm NH_{3}·H_{2}O$等物质的量混合所得盐是$\text{N}{{\text{H}}_{4}}\text{HC}{{\text{O}}_{3}}$,电离方程式为$\text{N}{{\text{H}}_{4}}\text{HC}{{\text{O}}_{3}}=\text{NH}_{4}^{+}+\text{HCO}_{3}^{-}$;$\rm HA$与$\rm Na_{3}PO_{4}$反应的离子方程式为$\text{HA}+\text{PO}_{4}^{3-}={{\text{A}}^{-}}+\text{HPO}_{4}^{2-}$;
$\rm 25\;\rm ^\circ\rm C$时,将等体积等浓度的醋酸和氨水混合,混合液中:$c(\text{C}{{\text{H}}_{3}}\text{CO}{{\text{O}}^{-}})$ $c(\text{NH}_{4}^{+})\rm ($填“$\rm \gt $”、“$\rm =$”或“$\rm \lt $”$\rm )$。
$\\rm =$
"]]$\rm 25\;\rm ^\circ\rm C$时,将等体积等浓度的醋酸和氨水混合,二者恰好反应生成醋酸铵,$\rm CH_{3}COOH$和$\rm NH_{3}$⋅$\rm H_{2}O$的电离平衡常数相同,则醋酸根离子和铵根离子的水解程度相等,所以醋酸铵溶液呈中性,根据电荷守恒得$c(\text{C}{{\text{H}}_{3}}\text{CO}{{\text{O}}^{-}})=c\left( \mathrm{NH}_{4}^{+} \right)$;
$\rm 25\;\rm ^\circ\rm C$时,向$\rm 10$ $\rm mL$ $\rm 0.01$ $\rm mol/L$ $\rm HA$溶液中滴加$V\,\text{mL}\,0.01\,\text{mol/L}$氨水,混合溶液中粒子浓度关系正确的是 。
$\rm A$.若混合液$\rm pH\gt 7$,则$V\ge 10$
$\rm B$.若混合液$\rm pH\lt 7$,则$c(\text{NH}_{4}^{+})\gt c({{\text{A}}^{-}})\gt c({{\text{H}}^{+}})\gt c(\text{O}{{\text{H}}^{-}})$
$\rm C$.$V=10$时,混合液中水电离程度大于$\rm 10$ $\rm mL$ $\rm 0.01$ $\rm mol/L$ $\rm HA$溶液中水的电离程度
$\rm D$.$V=5$时,$2c(\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O})+2c(\text{NH}_{4}^{+})=c({{\text{A}}^{-}})+c(\text{HA})$
$\\rm CD$
"]]$\rm A$.相同温度下,$\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O}$的电离程度远远大于$\rm HA$,则$\mathrm{N}{{\mathrm{H}}_{\mathrm{4}}}\mathrm{A}$溶液呈碱性,则$\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O}$的体积小于$\rm 10$ $\rm mL$,混合液也有可能$\rm pH\gt 7$,$\rm A$错误;
$\rm B$.若混合液$\rm pH\lt 7$,$c\left( {{\text{H}}^{+}} \right)\gt c\left( \text{O}{{\text{H}}^{-}} \right)$,根据电荷守恒$c(\text{NH}_{\text{4}}^{+})+c\left( {{\text{A}}^{-}} \right)=c\left( {{\text{H}}^{+}} \right)+c\left( \text{O}{{\text{H}}^{-}} \right)$可知,$c\text{(}{{\text{A}}^{-}}\text{)}\gt c\text{(NH}_{\text{4}}^{+}\text{)}$;
$\rm C$.$V=10$时,混合液中溶质是$\mathrm{N}{{\mathrm{H}}_{\mathrm{4}}}\mathrm{A}$,$\mathrm{N}{{\mathrm{H}}_{\mathrm{4}}}\mathrm{A}$水解促进水电离,则混合液中水电离程度大于$\rm 10$ $\rm mL$ $\rm 0.01$ $\rm mol/L$ $\rm HA$溶液中水的电离程度,$\rm C$正确;
$\rm D$.$V=5$时,根据溶液中物料守恒$2c(\text{N}{{\text{H}}_{3}}\cdot {{\text{H}}_{2}}\text{O})+2c(\text{NH}_{4}^{+})=c({{\text{A}}^{-}})+c(\text{HA})$,$\rm D$正确;
已知$\rm BaSO_{4}$的溶解度随温度升高而增大。如图所示,有${{T}_{1}}$、${{T}_{2}}$两种温度下两条$\rm BaSO_{4}$在水中的沉淀溶解平衡曲线,回答下列问题:
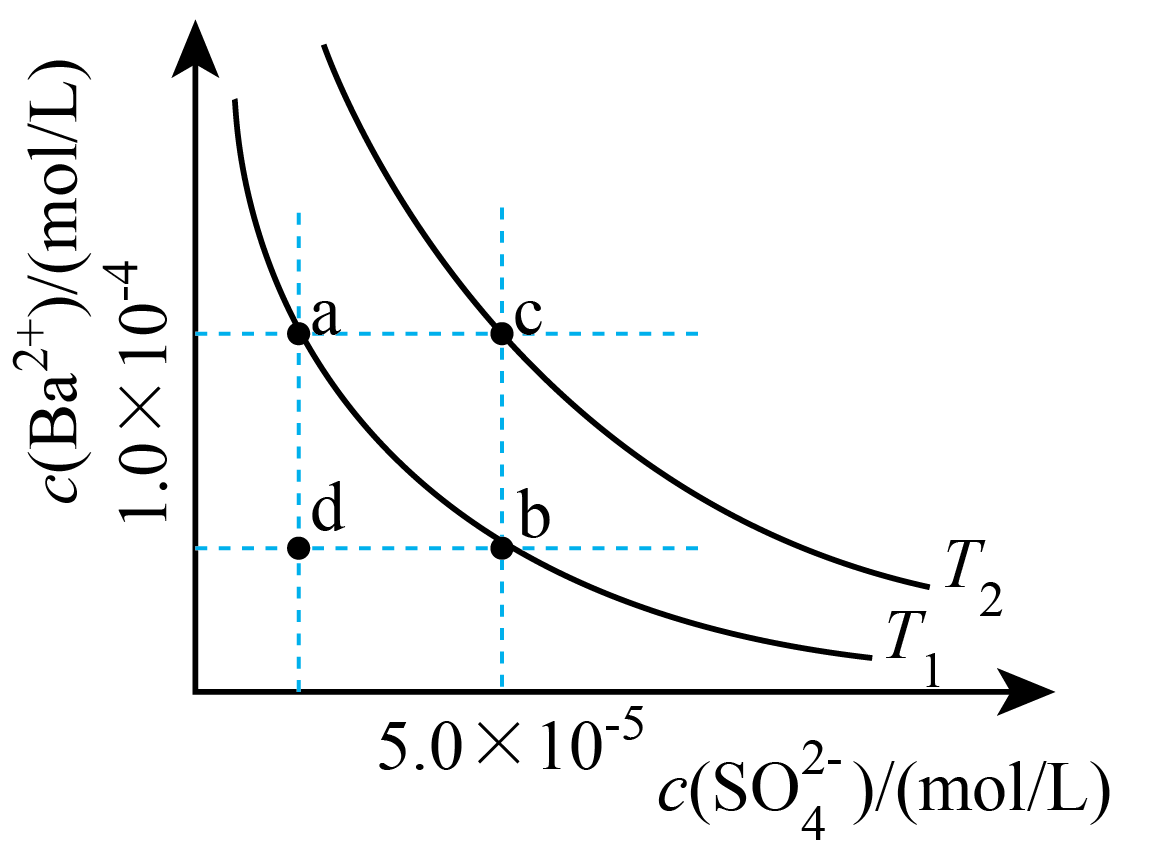
①${{T}_{1}}$ ${{T}_{2}}\rm ($填$\rm \gt $、$\rm =$、$\rm \lt )$。
②讨论${{T}_{1}}$温度时$\rm BaSO_{4}$的沉淀溶解平衡曲线,下列说法错误的是 。
$\rm A$.加入$\rm Na_{2}SO_{4}$可使溶液由$\rm a$点变为$\rm b$点
$\rm B$.在$ {{T}_{1}}$曲线上方区域$\rm ($不含曲线$\rm )$任意一点时,均有$\rm BaSO_{4}$沉淀生成
$\rm C$.蒸发溶剂可能使溶液由$\rm d$点变为曲线上$\rm a$、$\rm b$之间的某一点$\rm ($不含$\rm a$、$\rm b)$
$\rm D$.升温可使溶液由$\rm b$点变为$\rm d$点
$\\rm \\lt $ ; $\\rm D$
"]]①难溶电解质的溶解是吸热过程,升高温度,促进溶解,根据图可知,${{T}_{2}}$温度下溶度积大于${{T}_{1}}$温度,所以${{T}_{1}}\lt {{T}_{2}}$;
②$\rm A$.加入硫酸钠,抑制硫酸钡电离,导致溶液中钡离子浓度减小,可使溶液由$\rm a$点变为$\rm b$点,$\rm A$正确;
$\rm B$.${{T}_{1}}$曲线上方区域$\rm ($不含曲线$\rm )$为过饱和溶液,有晶体析出,则${{T}_{1}}$曲线上方区域$\rm ($不含曲线$\rm )$均有$\rm BaSO_{4}$沉淀生成,$\rm B$正确;
$\rm C$.蒸发溶剂会增大溶液中溶质浓度,温度不变,溶度积常数不变,可能使溶液由$\rm d$点变为曲线上$\rm a$、$\rm b$之间的某一点,$\rm C$正确;
$\rm D$.升高温度增大溶质溶解,溶液中硫酸根离子、钡离子浓度均增大,不能使$\rm b$点变为$\rm d$点,$\rm D$错误;
高中 | 盐溶液微粒间的三大守恒原理的理解及应用题目答案及解析(完整版)
