高中 | 金属的电化学防护 题目答案及解析
稿件来源:高途
高中 | 金属的电化学防护题目答案及解析如下,仅供参考!
选修四
第四章 电化学基础
第四节 金属的电化学腐蚀与防护
金属的电化学防护
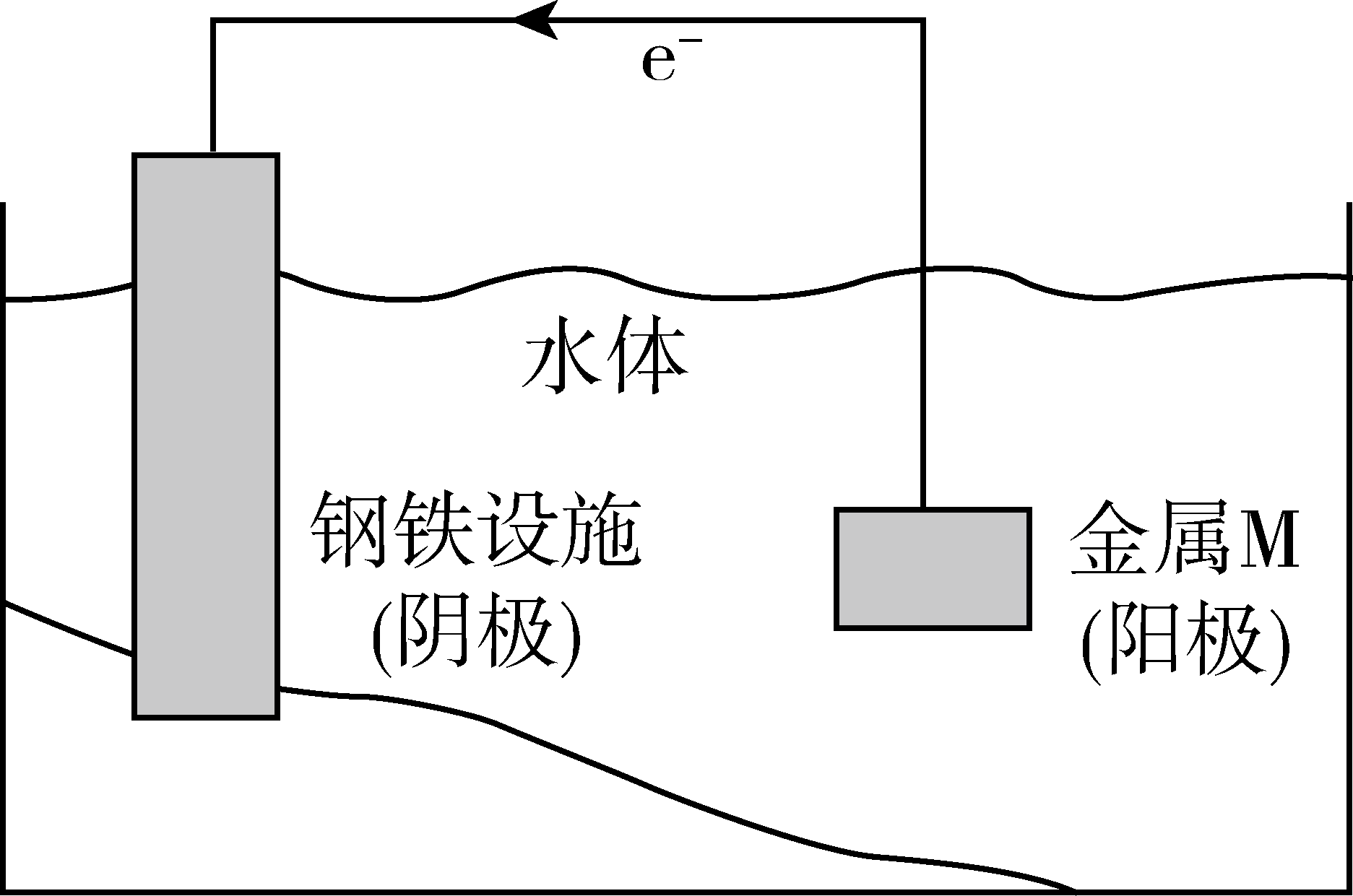
将金属$\rm M$连接在钢铁设施表面,可减缓水体中钢铁设施的腐蚀。在题图所示的情境中,下列有关说法正确的是$(\qquad)$
["
阴极的电极反应式为$\\mathrm{Fe}-2 \\mathrm{e}^{-}=\\mathrm{Fe}^{2+}$
","金属$\\rm M$的活动性比$\\rm Fe$的活动性弱
","钢铁设施表面因积累大量电子而被保护
","钢铁设施在河水中的腐蚀速率比在海水中的快
"][["C"]]
该装置为原电池原理的金属防护措施,为牺牲阳极的阴极保护法,金属$\rm M$作负极,钢铁设备作正极,据此分析解答。
$\rm A\rm .$阴极的钢铁设施实际作原电池的正极,正极金属被保护不失电子,故$\rm A$错误;
$\rm B\rm .$阳极金属$\rm M$实际为原电池装置的负极,电子流出,原电池中负极金属比正极活泼,因此$\rm M$活动性比$\rm Fe$的活动性强,故$\rm B$错误;
$\rm C\rm .$金属$\rm M$失电子,电子经导线流入钢铁设备,从而使钢铁设施表面积累大量电子,自身金属不再失电子从而被保护,故$\rm C$正确;
$\rm D\rm .$海水中的离子浓度大于河水中的离子浓度,离子浓度越大,溶液的导电性越强,因此钢铁设施在海水中的腐蚀速率比在河水中快,故$\rm D$错误;
故选:$\rm C$
高中 | 金属的电化学防护题目答案及解析(完整版)
去刷题
今日推荐 ![]()
![]()
![]()
