高中 | 导电的原因及条件 题目答案及解析
稿件来源:高途
高中 | 导电的原因及条件题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
导电的原因及条件
电能是现代社会应用最广泛的能源之一、某原电池装置如图所示,$\rm A$为电流表。
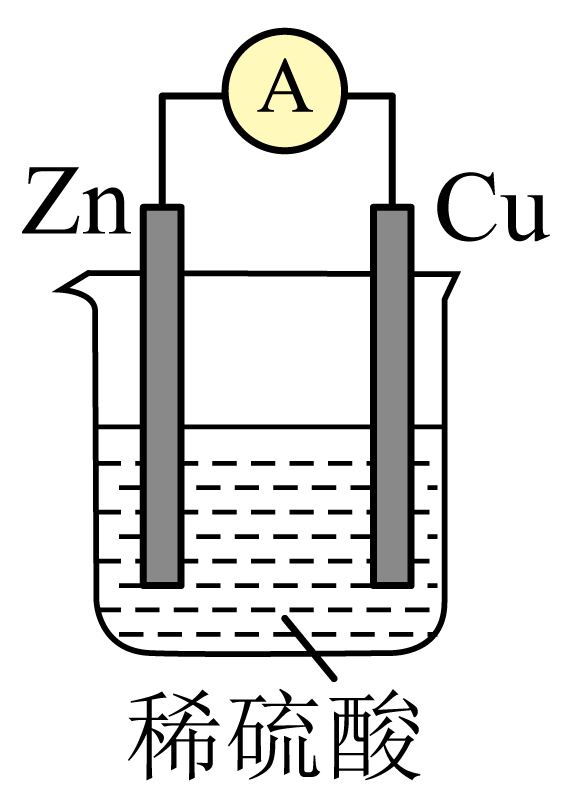
$\rm Zn$电极为原电池的 极$\rm ($填“正”或“负”$\rm )$,电极反应式是 。
负 ; $\\text{Zn-2}{{\\text{e}}^{-}}=\\text{Z}{{\\text{n}}^{\\text{2+}}}$
"]]在原电池中,一般情况下,较活泼的金属为负极,较不活泼的金属或能导电的非金属为正极,由于活泼性:$\rm Zn\gt Cu$,因此$\rm Zn$为原电池的负极,电极反应式为:$\text{Zn-2}{{\text{e}}^{-}}=\text{Z}{{\text{n}}^{\text{2+}}}$;
$\rm Cu$电极上发生的反应属于 $\rm ($填“氧化”或“还原$\rm )$反应,当铜表面析出$\rm 4.48$ $\rm L$氢气$\rm ($标准状况$\rm )$时,导线中通过了 $\rm mol$电子。
还原 ; $\\rm 0.4$
"]]$\rm Cu$为原电池的正极,正极发生还原反应,电极反应式为$\rm 2H^{+}+2e^{-}=H_{2}↑$,每生成$\rm 1$ $\rm mol$ $\rm H_{2}$,转移$\rm 2\;\rm mol$电子,当铜表面析出$\rm 4.48\;\rm L($标准状况$\rm )$即$\rm 0.2$ $\rm mol$ $\rm H_{2}$时,导线中通过了$\rm 0.4\;\rm mol$电子;
能证明化学能转化为电能的实验现象是:铜片上有气泡产生、 。
电流表指针发生偏转
"]]原电池将化学能转化为电能时,有电流通过外电路,电流表指针发生偏转;
下列反应通过原电池装置,可实现化学能直接转化为电能的是 。
$\rm A$.$\rm \text{CaO}+{{\text{H}}_{2}}\text{O}=\text{Ca}{{\left( \text{OH} \right)}_{2}}$ $\rm B$.$\rm 2 \mathrm{H}_{2}+\mathrm{O}_{2}=2 \mathrm{H}_{2} \mathrm{O}$
$\rm C$.$\rm 2 \mathrm{FeCl}_{3}+\mathrm{Cu}=\mathrm{CuCl}_{2}+2 \mathrm{FeCl}_{2}$ $\rm D$.$\rm \mathrm{HCl}+\mathrm{NaOH}=\mathrm{H}_{2} \mathrm{O}+\mathrm{NaCl}$
$\\rm BC$
"]]原电池是把化学能转化为电能的装置,发生的反应是氧化还原反应,即有元素化合价变化,选项中$\rm BC$为氧化还原反应,故选:$\rm BC$。
如图所示是电解池装置中图$\rm 1$灯泡不亮,图$\rm 2$灯泡发亮,由此能得出的结论是 。
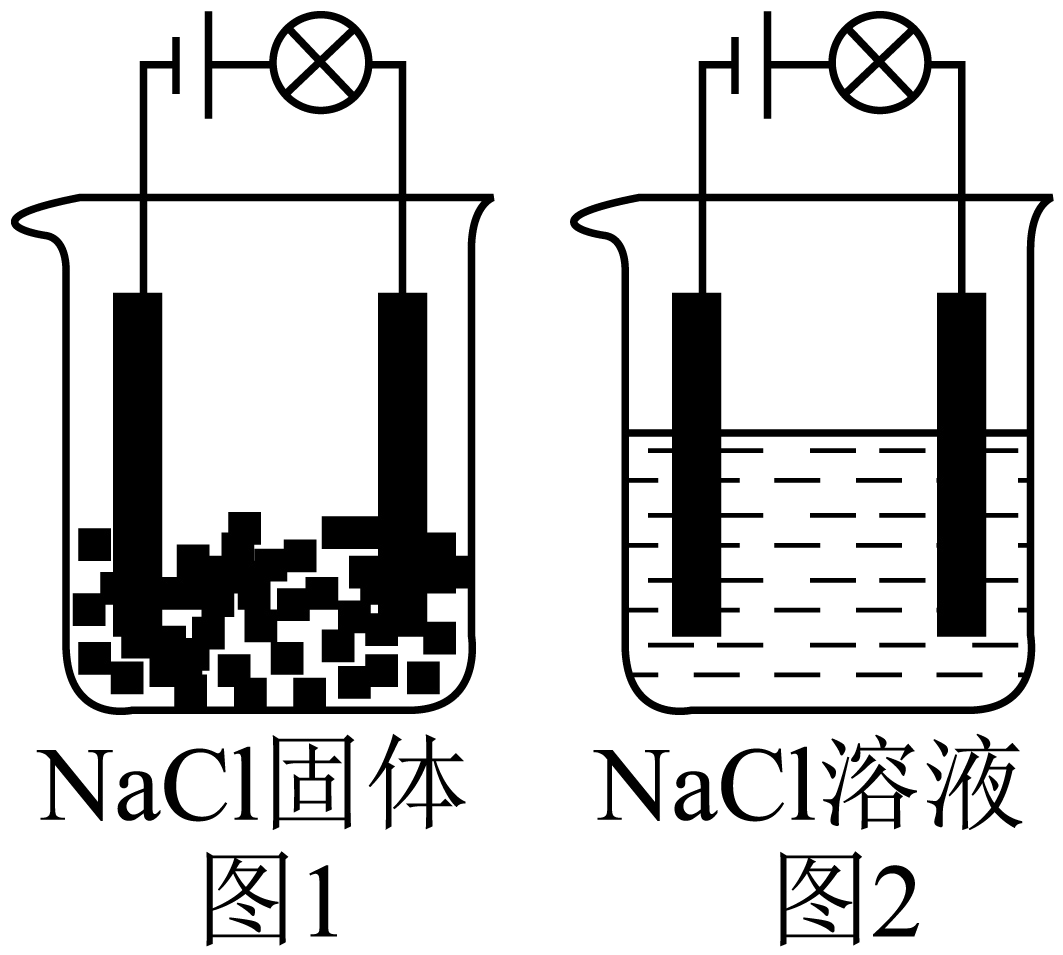
$\rm A$.图$\rm 1$灯泡不亮的原因是$\rm NaCl$没有发生电离 $\rm B$.图$\rm 2$灯泡亮说明$\rm NaCl$溶液是电解质,能导电
$\rm C$.$\rm NaCl$要发生电离必须有水存在 $\rm D$.电解质在电流的作用下才能发生电离
$\\rm A$
"]]$\rm A$.$\rm NaCl$溶于水或熔融状态下才能发生电离,固体$\rm NaCl$中的离子不能移动,故$\rm NaCl$固体没有发生电离,也不导电,故$\rm A$正确;
$\rm B$.灯泡亮说明$\rm NaCl$溶液能导电,但$\rm NaCl$溶液是混合物,不属于电解质,$\rm NaCl$是电解质,故$\rm B$错误;
$\rm C$.$\rm NaCl$溶于水或熔融状态下均可发生电离,故$\rm C$错误;
$\rm D$.电解质溶于水或熔化条件下发生电离,与电流无关,故$\rm D$错误;
故选:$\rm A$;
据资料显示,全世界每年因腐蚀而报废的金属材料相当于其年产量的$\rm 20\%$以上。金属防腐的方法很多,常用方法有 。
$\rm A$.喷涂油漆 $\rm B$.电镀金属 $\rm C$.电化学保护法 $\rm D$.制成不锈钢
$\\rm ABCD$
"]]金属防腐的方法很多,常用方法有:改变金属内部结构,如:制成合金;加保护层,如:涂漆、涂油、电镀等;电化学保护法,如:牺牲阳极的阴极保护法、外加电源的阴极保护法等,故选:$\rm ABCD$。
高中 | 导电的原因及条件题目答案及解析(完整版)
