高中 | 导电的原因及条件 题目答案及解析
稿件来源:高途
高中 | 导电的原因及条件题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
导电的原因及条件
数字化实验是化学研究的重要手段。某课外兴趣小组为了探究溶液中的离子反应与溶液电导率的关系,进行了如下实验:向含有酚酞的$\rm Ba(OH)_{2}$溶液中逐滴加入$\rm H_{2}SO_{4}$溶液,测得溶液的电导率与时间变化如图所示。$\rm ($已知溶液导电性越强,电导率越大$\rm )$
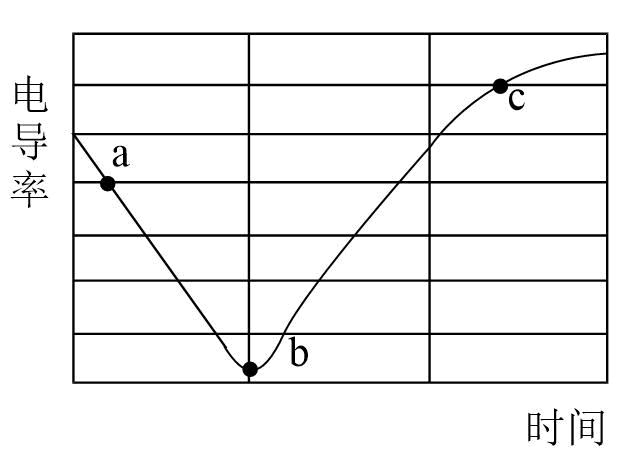
$\rm Ba(OH)_{2}$属于 $\rm ($填“强电解质”或“弱电解质”$\rm )$。请书写$\rm Ba(OH)_{2}$的电离方程式 。
强电解质;$\\rm Ba(OH{{)}_{2}}=B{{a}^{2+}}+2O{{H}^{-}}$
"]]$\rm Ba(OH)_{2}$属于强碱,能完全电离,属于强电解质,$\rm Ba(OH)_{2}$电离出钡离子和氢氧根离子,电离方程式$\rm Ba(OH{{)}_{2}}=B{{a}^{2+}}+2O{{H}^{-}}$。
试使用离子方程式解释图中$\rm ab$段电导率变化的原因。
$\\rm B{{a}^{2+}}+2O{{H}^{-}}+2{{H}^{+}}+SO_{4}^{2-}=BaS{{O}_{4}}\\downarrow +2{{H}_{2}}O$
"]]图中$\rm ab$段电导率变小是因为$\rm Ba(OH)_{2}$与$\rm H_{2}SO_{4}$反应生成硫酸钡沉淀和水,导致溶液中离子浓度减小,离子方程式:$\rm B{{a}^{2+}}+2O{{H}^{-}}+2{{H}^{+}}+SO_{4}^{2-}=BaS{{O}_{4}}\downarrow +2{{H}_{2}}O$。
结合电导率变化曲线,完成下表填空。
| 端点 | 澄清$\rm /$浑浊 | 溶液颜色 | 溶液酸碱性 |
| $\rm a$点 | 澄清 | 碱性 | |
| $\rm b$点 | 浑浊 | ||
| $\rm c$点 | 无色 | 酸性 |
红色;无色;中性;浑浊
"]]含有酚酞的溶液遇碱变蓝,中性或酸性溶液呈无色,$\rm a$点有过量含有酚酞的$\rm Ba(OH)_{2}$溶液,溶液呈碱性,因此溶液呈红色,$\rm b$点$\rm Ba(OH)_{2}$恰好被硫酸消耗完,溶液呈中性,溶液显无色,$\rm c$点是过量稀硫酸,溶液中仍存在硫酸钡沉淀则是浑浊的。
根据上述信息,判断$\rm Ba(OH)_{2}$与$\rm H_{2}SO_{4}$的浓度大小关系为:$c\rm [Ba(OH)_{2}]$ $c{\rm (H_{2}SO_{4})}($填“$\rm \gt $”、“$\rm =$”或“$\rm \lt $”$\rm )$。
$\\rm \\lt $
"]]由$\rm c$点电导率比$\rm a$点高,说明硫酸的导电能力比氢氧化钡的强,则硫酸浓度较大,$c{\rm [Ba(OH)_{2}]}\lt c{\rm (H_{2}SO_{4})}$。
若用等浓度的$\rm BaCl_{2}$替换$\rm Ba(OH)_{2}$溶液,则电导率最低的点与图中$\rm b$点的位置关系为 。
$\rm A$.在$\rm b$上方
$\rm B$.在$\rm b$下方
$\rm C$.与$\rm b$重合
$\rm D$.无法确定
$\\rm A$
"]]若用等浓度的$\rm BaCl_{2}$替换$\rm Ba(OH)_{2}$溶液,$\rm BaCl_{2}$与硫酸反应生成硫酸钡沉淀和$\rm HCl$,恰好反应时仍有大量的$\rm H^{+}$、$\rm Cl^{-}$自由移动,导电能力较大,则电导率最低的点在$\rm b$上方,故$\rm A$选。
高中 | 导电的原因及条件题目答案及解析(完整版)
