高中 | 导电的原因及条件 题目答案及解析
稿件来源:高途
高中 | 导电的原因及条件题目答案及解析如下,仅供参考!
必修一
第二章 化学物质及其变化
第二节 离子反应
导电的原因及条件
有机酸种类繁多。下表是一些有机酸的电离平衡常数$\rm (25\ ^\circ \text{C})$。
| 有机酸 | $\rm C{{H}_{3}}COOH$ | $\rm CHC{{l}_{2}}COOH$ | $\rm C{{H}_{2}}BrCOOH$ | $\rm HOOC-COOH$ |
| 电离平衡常数$ K_{{\rm a}}$ | $\rm 1.8 \times 10^{-5}$ | $\rm 5.0\times {{10}^{-2}}$ | $\rm 1.3\times {{10}^{-3}}$ | ${{K}_{\rm a1}}=5.4\times {{10}^{-2}}$,${{K}_{\rm a2}}=5.4\times {{10}^{-5}}$ |
分析乙酸的官能团结构,可以使用以下仪器分析手段 $\rm ($不定项$\rm )$。
$\rm A$.原子吸收光谱
$\rm B$.红外光谱
$\rm C$.质谱
$\rm D$.射线衍射
$\\rm BD$
"]]$\rm A$.原子吸收光谱利用光谱上的特征谱线来鉴定元素,$\rm A$错误。
$\rm B$.红外光谱测定未知物中所含有各种化学键和官能团,判断结构,$\rm B$正确。
$\rm C$.质谱通过分析最大的碎片离子测出分子的相对质量,$\rm C$错误。
$\rm D$.射线衍射可识别微观粒子的结构,$\rm D$正确。
$\rm C{{H}_{2}}BrCOOH$与少量$\rm {Na}_{2} {C}_{2} {O}_{4}$溶液反应的化学方程式是: 。
$\\rm {{{CH}}}_{2}{{BrCOOH}} + {{{Na}}}_{2}{{C}}_{2}{{O}}_{4} = {{{CH}}}_{2}{{BrCOONa}} + {{{NaHC}}}_{2}{{O}}_{4}$
"]]由电离平衡常数可知酸性:$\rm {HC}_2 {O}_4\gt C{{H}_{2}}BrCOOH\gt H{{C}_{2}}O_{4}^{-}$,依据强酸制弱酸判断$\rm C{{H}_{2}}BrCOOH$与少量$\rm {Na}_{2} {C}_{2} {O}_{4}$溶液反应的化学方程式是:$\rm {{{CH}}}_{2}{{BrCOOH}} + {{{Na}}}_{2}{{C}}_{2}{{O}}_{4} = {{{CH}}}_{2}{{BrCOONa}} + {{{NaHC}}}_{2}{{O}}_{4}$。
$\rm C{{H}_{2}}ClCOOH$的电离平衡常数可能是 。
$\rm A$.$\rm 6.4 \times 10^{-6}$
$\rm B$.$\rm 3.9\times {{10}^{-4}}$
$\rm C$.$\rm 1.4\times {{10}^{-3}}$
$\rm D$.$\rm 8.0\times {{10}^{-2}}$
$\\rm C$
"]]$\rm HOOC-COOH$含两个羧基酸性较强,$\rm C{{H}_{2}}ClCOOH$只含一个羧基,酸性小于$\rm HOOC-COOH$,$\rm C{{H}_{3}}-$是推电子基团,导致羧基中$\rm O-H$键极性减小,酸性减弱;$\rm C{{H}_{2}}Br-$、$\rm C{{H}_{2}}Cl-$、$\rm CHC{{l}_{2}}-$均是吸电子基团,导致羧基中$\rm O-H$键极性增大,酸性增强,数量越多,吸电子能力越强,其中电负性:$\rm Cl\gt Br$,吸电子能力$\rm C{{H}_{2}}Br-\lt C{{H}_{2}}Cl-CHC{{l}_{2}}-$,故$\rm C{{H}_{2}}ClCOOH$的电离平衡常数介于$\rm C{{H}_{2}}BrCOOH$和$\rm CHC{{l}_{2}}COOH$之间,故选$\rm C$。
$\rm 25\ ^\circ \text{C}$时,相同$\rm pH$的两种一元弱酸$\rm C{{H}_{3}}COOH$与$\rm CHC{{l}_{2}}COOH$溶液分别加水稀释,溶液$\rm pH$随溶液体积变化的曲线如图所示。下列说法正确的是 $\rm ($不定项$\rm )$。
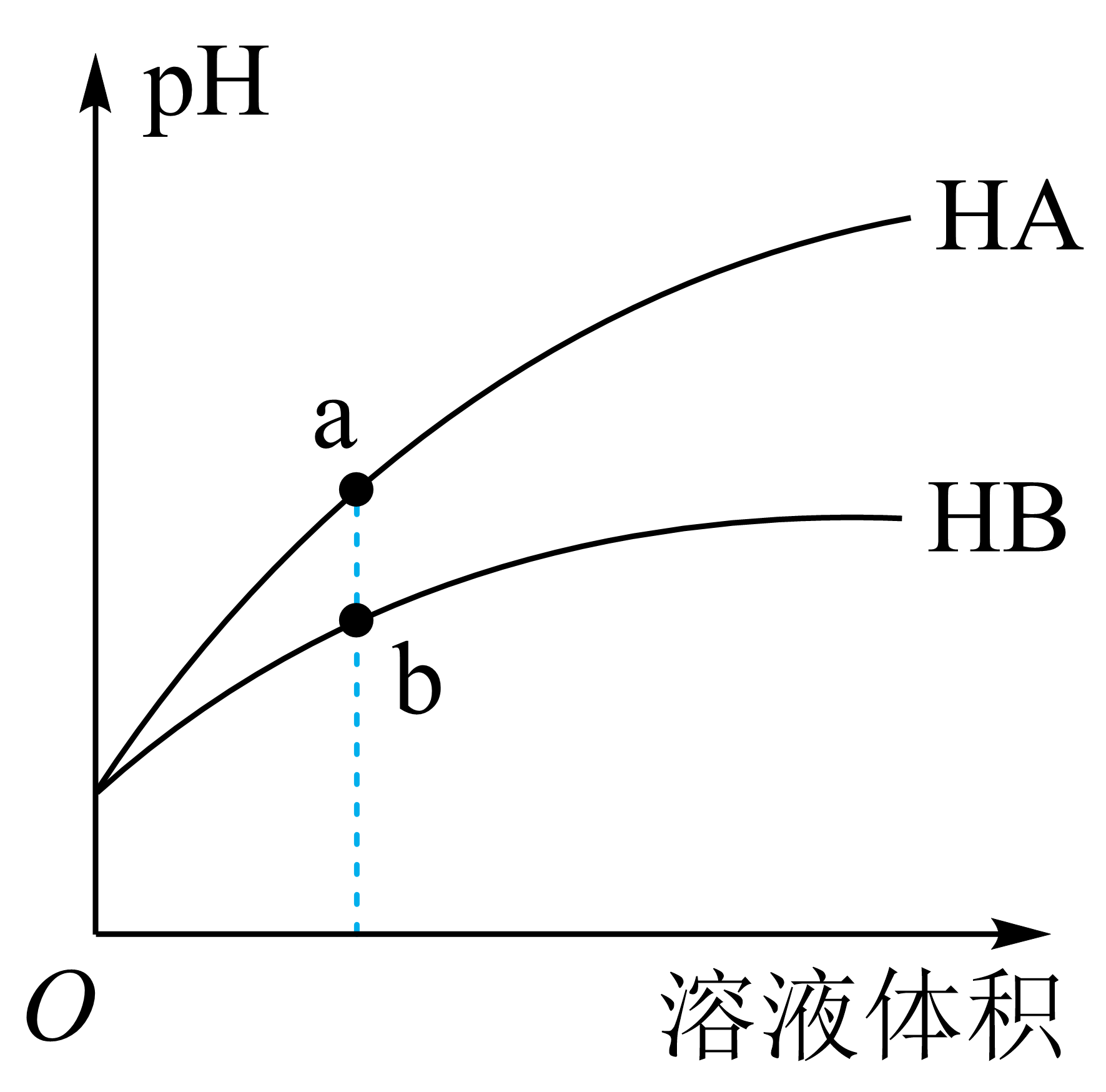
$\rm A$.$\rm a$点的$\rm \left[ {{H}^{+}} \right]$大于$\rm b$点的$\rm \left[ {{H}^{+}} \right]$
$\rm B$.$\rm a$点溶液的导电性小于$\rm b$点溶液
$\rm C$.同浓度的$\rm NaA$与$\rm NaB$溶液中,$\rm \left\lbrack {{A}}^{ - }\right\rbrack$大于$\rm \left\lbrack {{B}}^{ - }\right\rbrack$
$\rm D$.$\rm HA$是$\rm C{{H}_{3}}COOH$
$\\rm BC$
"]]$\rm pH$相同的酸,稀释相同倍数时,酸性强的酸的$\rm pH$的变化大,酸性较弱的酸的$\rm pH$的变化小。
$\rm A$.$\rm A$的$\rm pH$大于$\rm b$点,$\rm a$点的$\rm \left[ {{H}^{+}} \right]$小于$\rm b$点的$\rm \left[ {{H}^{+}} \right]$,$\rm A$错误。
$\rm B$.在这两种酸溶液中,$c{\rm (H^{+})}≈c{\rm (A^{-})}$,$c{\rm (H^{+})}≈c{\rm (B^{-})}$,而$\rm a$点的$c{\rm (H^{+})}$小于$\rm b$点的$c{\rm (H^{+})}$,故$\rm a$点的$c{\rm (A^{-})}$小于$\rm b$点的$c{\rm (B^{-})}$,即$\rm a$点的离子浓度小于$\rm b$点的离子浓度,故$\rm a$点的导电能力小于$\rm b$点,故$\rm B$错误。
$\rm C$.在稀释前两种酸的$\rm pH$相同,而两种酸的酸性:$\rm HA\gt HB$,形成盐后酸根离子越弱越水解,故水解程度:$\rm A^{-}\lt B^{-}$,则$\rm \left\lbrack {{A}}^{ - }\right\rbrack$大于$\rm \left\lbrack {{B}}^{ - }\right\rbrack$,故$\rm C$正确。
$\rm D$.由电离平衡常数可知酸性:$\rm CHC{{l}_{2}}COOH\gt C{{H}_{3}}COOH$,故$\rm HA$为酸性强的$\rm CHC{{l}_{2}}COOH$,故$\rm D$错误。
常温下,将$\rm 0.1\ mol\cdot {{L}^{-1}}\ NaOH$溶液滴加到$\rm {20}{\;{mL}}\ {0.1}{{\ mol}} \cdot {{L}}^{-1}\ {{H}}_{2}{{C}}_{2}{{O}}_{4}$溶液中,混合溶液的$\rm pH$随$\rm NaOH$溶液滴入量的关系如图所示。
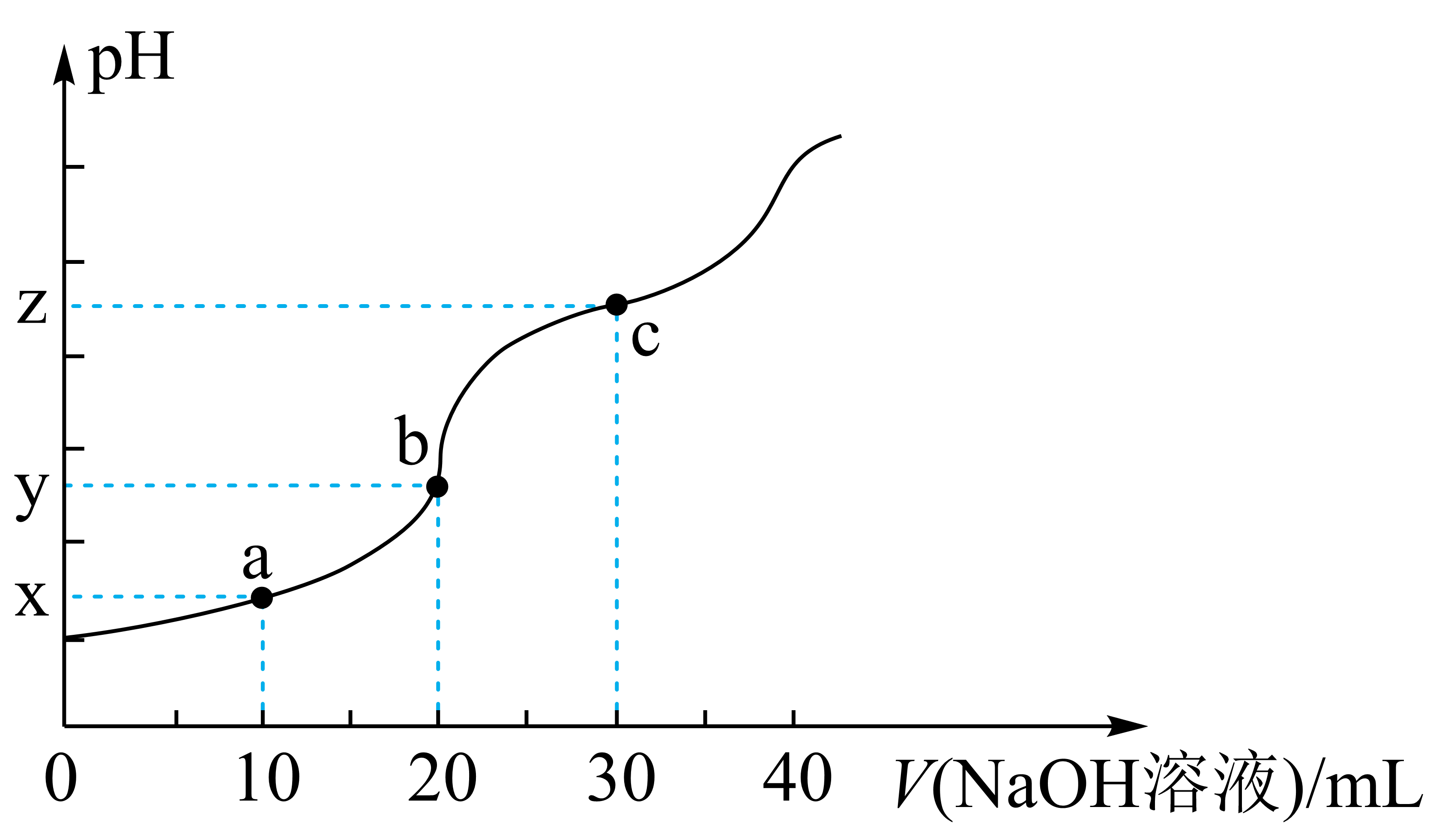
①$\rm z$的近似数值是 $\rm ($保留$\rm 1$位小数$\rm )$。
②$\rm b$点时$\rm \left[ {{H}_{2}}{{C}_{2}}{{O}_{4}} \right]$ $\rm \left[ {{C}_{2}}O_{4}^{2-} \right]($填$\rm \gt $、$\rm \lt $或$\rm =)$
$\\rm 4.3$;$\\rm \\lt $
"]]①$\rm c$点为等物质的量的$\rm {Na}_{2} {C}_{2} {O}_{4}$和$\rm NaH{{C}_{2}}{{O}_{4}}$混合溶液,缓冲溶液的${\rm pH=p}{{K}_{\rm a2}}+\dfrac{c{\rm ({{C}_{2}}O_{4}^{2-})}}{c{\rm (H{{C}_{2}}O_{4}^{-})}}$,$c{\rm ({{C}_{2}}O_{4}^{2-})}\approx c{\rm (H{{C}_{2}}O_{4}^{-})}$,${\rm pH}\approx p{{K}_{\rm a2}}\approx 4.3$;
②$\rm b$点为$\rm NaH{{C}_{2}}{{O}_{4}}$溶液,${{K}_{\rm h}}{\rm (H{{A}^{-}})}=\dfrac{{{K}_{\rm w}}}{{{K}_{\rm a1}}\rm ({{H}_{2}}A)}=\dfrac{{{10}^{-14}}}{5.4\times {{10}^{-2}}}\lt {{K}_{\rm a2}}$,电离大于水解,故$\rm \left[ {{H}_{2}}{{C}_{2}}{{O}_{4}} \right]\lt \left[ {{C}_{2}}O_{4}^{2-} \right]$。
高中 | 导电的原因及条件题目答案及解析(完整版)
