高中 | 原子晶体 题目答案及解析
稿件来源:高途
高中 | 原子晶体题目答案及解析如下,仅供参考!
选修三
第三章 晶体结构与性质
第二节 分子晶体与原子晶体
原子晶体
$\rm C_{60}$可用作储氢材料。继$\rm C_{60}$后,科学家又合成了$\rm Si_{60}$、$\rm N_{60}$,它们的结构相似,下列有关说法正确的是$\rm (\qquad)$
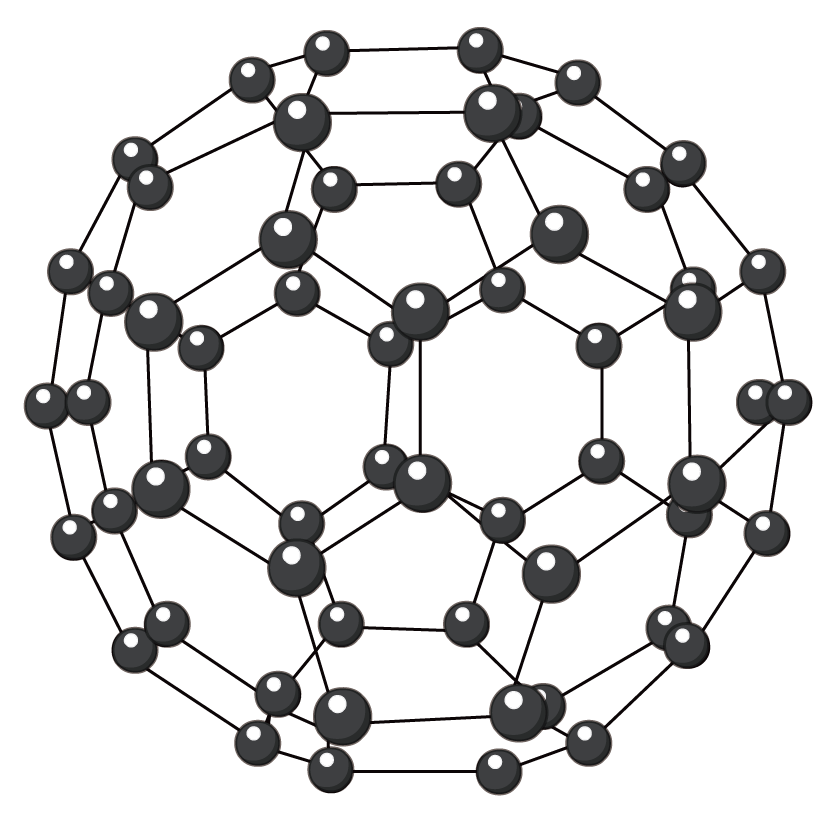
足球烯$\rm C_{60}$
$\\rm C_{60}$、$\\rm Si_{60}$、$\\rm N_{60}$都属于共价晶体
","$\\rm C_{60}$、$\\rm Si_{60}$、$\\rm N_{60}$分子内共用电子对数目相同
","$\\rm N_{60}$结构中只存在$\\rm \\sigma$键,而$\\rm C_{60}$结构中既有$\\rm \\sigma$键又有$\\rm \\pi$键
","已知金刚石中$\\rm C-C$键长$\\rm 154\\ pm$,$\\rm C_{60}$中$\\rm C-C$键长$\\rm 140\\sim 145\\ pm$,故$\\rm C_{60}$熔点高于金刚石
"]$\rm A$.$\rm C_{60}$、$\rm Si_{60}$、$\rm N_{60}$都属于分子晶体,故$\rm A$错误。
$\rm B$.氮原子形成三个共价键,而碳原子和硅原子形成$\rm 4$个共价键,$\rm C_{60}$、$\rm Si_{60}$、$\rm N_{60}$分子内共用电子对数目不相同,故$\rm B$错误。
$\rm C$.氮原子形成三个共价键,$\rm N_{60}$结构中只存在$\rm \sigma$键,碳原子可形成四个共价键,结构中既有$\rm \sigma$键又有$\rm \pi$键,故$\rm C$正确。
$\rm D$.金刚石属于共价晶体,$\rm C_{60}$属于分子晶体,共价晶体熔化,需克服共价键,分子晶体熔化只需克服范德华力,故金刚石的熔点高于$\rm C_{60}$,故$\rm D$错误。
故选:$\rm C$
高中 | 原子晶体题目答案及解析(完整版)
