高中 | 盐类水解常数 题目答案及解析
稿件来源:高途
高中 | 盐类水解常数题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐类水解常数
溶液的酸碱性会影响微粒的存在形式。已知:$\rm 25\;\rm ^\circ\rm C$下列弱酸的电离常数
| $\rm HF$ | $\text{C}{{\text{H}}_{3}}\text{COOH}$ | ${{\text{H}}_{2}}\text{C}{{\text{O}}_{3}}$ | $\rm HCN$ |
| ${{K}_{\text{a}}}=3.5\times {{10}^{-4}}$ | ${{K}_{\text{a}}}=1.8\times {{10}^{-5}}$ | ${{K}_{\text{a}1}}=4.3\times {{10}^{-7}}$、${{K}_{\text{a}2}}=5.6\times {{10}^{-11}}$ | ${{K}_{\text{a}}}=6.2\times {{10}^{-10}}$ |
室温下,物质的量浓度均为$0.1\;\rm \text{mol}\cdot {{\text{L}}^{-1}}$的四种溶液,其$\rm pH$由小到大排列的顺序是$(\quad\ \ \ \ )$。$\rm ($用序号表示$\rm )$
$\\text{N}{{\\text{a}}_{2}}\\text{C}{{\\text{O}}_{3}}$
","$\\text{C}{{\\text{H}}_{3}}\\text{COONa}$
","$\\rm NaF$
","$\\text{NaHC}{{\\text{O}}_{3}}$
"]由电离常数可知,弱酸或酸式根离子在溶液中的电离程度大小顺序为$\rm HF\gt CH_{3}COOH\gt H_{2}CO_{3}\gt HCO_{\text{3}}^{-}$,由水解规律可知,浓度相等的四种盐溶液的$\rm pH$由小到大排列的顺序为$\rm NaF\lt CH_{3}COONa\lt NaHCO_{3}\lt Na_{2}CO_{3}$,即$\rm C\lt B\lt D\lt A$;
向$\rm NaCN$溶液中通入少量$\text{C}{{\text{O}}_{2}}$,化学方程式为 。
$\\rm CN^{-}+$ $\\rm CO_{2}+H_{2}O=HCN+$ $\\text{HCO}_{\\text{3}}^{-}$
"]]由电离常数可知,$\rm HCN$的电离程度小于$\rm H_{2}CO_{3}$,大于$\text{HCO}_{\text{3}}^{-}$,则由强酸制弱酸的原理可知,$\rm NaCN$溶液与少量$\rm CO_{2}$反应生成$\rm HCN$和$\rm NaHCO_{3}$,反应的离子方程式为$\rm CN^{-}+CO_{2}+H_{2}O=HCN+\text{HCO}_{\text{3}}^{-}$;
$\text{N}{{\text{a}}_{2}}\text{C}{{\text{O}}_{3}}$溶液中电荷守恒关系式为 。
$c{(\\rm Na^{+})}+c{(\\rm H^{+})}=2c(\\text{CO}_{\\text{3}}^{\\text{2-}} )+c(\\text{HCO}_{\\text{3}}^{-}\\rm )+c(\\rm OH^{-})$
"]]碳酸钠溶液中存在电荷守恒关系为$c{(\rm Na^{+})}+c{(\rm H^{+})}=2c(\text{CO}_{\text{3}}^{\text{2-}} )+c(\text{HCO}_{\text{3}}^{-}\rm )+c(\rm OH^{-})$;
不能证明$\rm HF$是弱电解质的方法是$(\quad\ \ \ \ )$。
常温下,测得$0.1\\;\\rm \\text{mol}\\cdot {{\\text{L}}^{-1}}\\text{HF}$的$\\rm pH\\gt 1$
","常温下,测得$\\rm NaF$溶液的$\\rm pH\\gt 7$
","常温下,$\\rm pH=2$的$\\rm HF$溶液加水稀释至$\\rm 100$倍后$\\rm pH\\lt 4$
","常温下,$10\\;\\rm \\text{mL}\\;\\rm 0.1\\;\\rm \\text{mol}\\cdot {{\\text{L}}^{-1}}$的$\\rm HF$溶液恰好与$10\\;\\rm \\text{mL}\\;\\rm 0.1\\;\\rm \\text{mol}\\cdot {{\\text{L}}^{-1}}\\text{NaOH}$溶液完全反应
"]$\rm A$.常温下,$\rm 0.1\;\rm mol/L$ $\rm HF$溶液的$\rm pH$大于$\rm 1$,说明$\rm HF$在溶液中部分电离,$\rm HF$属于弱酸,故$\rm A$不符合题意;
$\rm B$.常温下,测得$\rm NaF$溶液$\rm pH$大于$\rm 7$,说明$\rm F^{-}$发生了水解,则$\rm HF$属于弱酸,故$\rm B$不符合题意;
$\rm C$.常温下,$\rm pH$为$\rm 2$的$\rm HF$溶液加水稀释至$\rm 100$倍后,$\rm pH\lt 4$,说明$\rm HF$溶液中存在电离平衡,$\rm HF$属于弱酸,故$\rm C$不符合题意;
$\rm D$.常温下,等体积等浓度的$\rm HF$溶液与$\rm NaOH$溶液恰好反应,只能说明$\rm HF$为一元酸,不能确定$\rm HF$的酸性强弱,故$\rm D$符合题意;
故选:$\rm D$;
室温下,$0.1\;\rm \text{mol}\cdot {{\text{L}}^{-1}}\text{NaHC}{{\text{O}}_{3}}$溶液显 性,结合上表数据加以解释 。
碱性; $\\text{HCO}_{\\text{3}}^{-}$的水解常数$ K_{\\rm h}=\\dfrac{{{{K}}_{\\text{w}}}}{{{{K}}_{\\text{a1}}}} =\\dfrac{1.0\\times {{10}^{-14}}}{4.3\\times {{10}^{-7}}} =2.3\\times 10^{-8}\\gt K_{\\rm a2}$,说明$\\text{HCO}_{\\text{3}}^{-}$在溶液中的水解程度大于电离程度
"]]$\text{HCO}_{\text{3}}^{-}$在溶液中的水解常数$ K_{\rm h}=\dfrac{{{{K}}_{\text{w}}}}{{{{K}}_{\text{a1}}}} =\dfrac{1.0\times {{10}^{-14}}}{4.3\times {{10}^{-7}}} =2.3\times 10^{-8}\gt K_{\rm a2}$,说明$\text{HCO}_{\text{3}}^{-}$在溶液中的水解程度大于电离程度,溶液呈碱性;
以酚酞为指示剂,用$0.3000 \mathrm{mol} \cdot \mathrm{L}^{-1}$的$\rm NaOH$溶液滴定$\rm 20.00\;\rm mL$,$0.3 \mathrm{mol} \cdot \mathrm{L}^{-1}$的弱酸${{\text{H}}_{3}}\text{A}$溶液,溶液中,含$\rm A$的粒子分布系数$\rm \delta$随溶液$\rm pH$的变化关系如图所示$\rm [$比如${{\text{H}}_{3}}\text{A}$的分布系数$\delta \left( {{\text{H}}_{3}}\text{A} \right)=\dfrac{c\left( {{\text{H}}_{3}}\text{A} \right)}{0.3\;\rm \text{mol}\cdot {{\text{L}}^{-1}}}\rm ]$。下列叙述正确的是$(\quad\ \ \ \ )$。
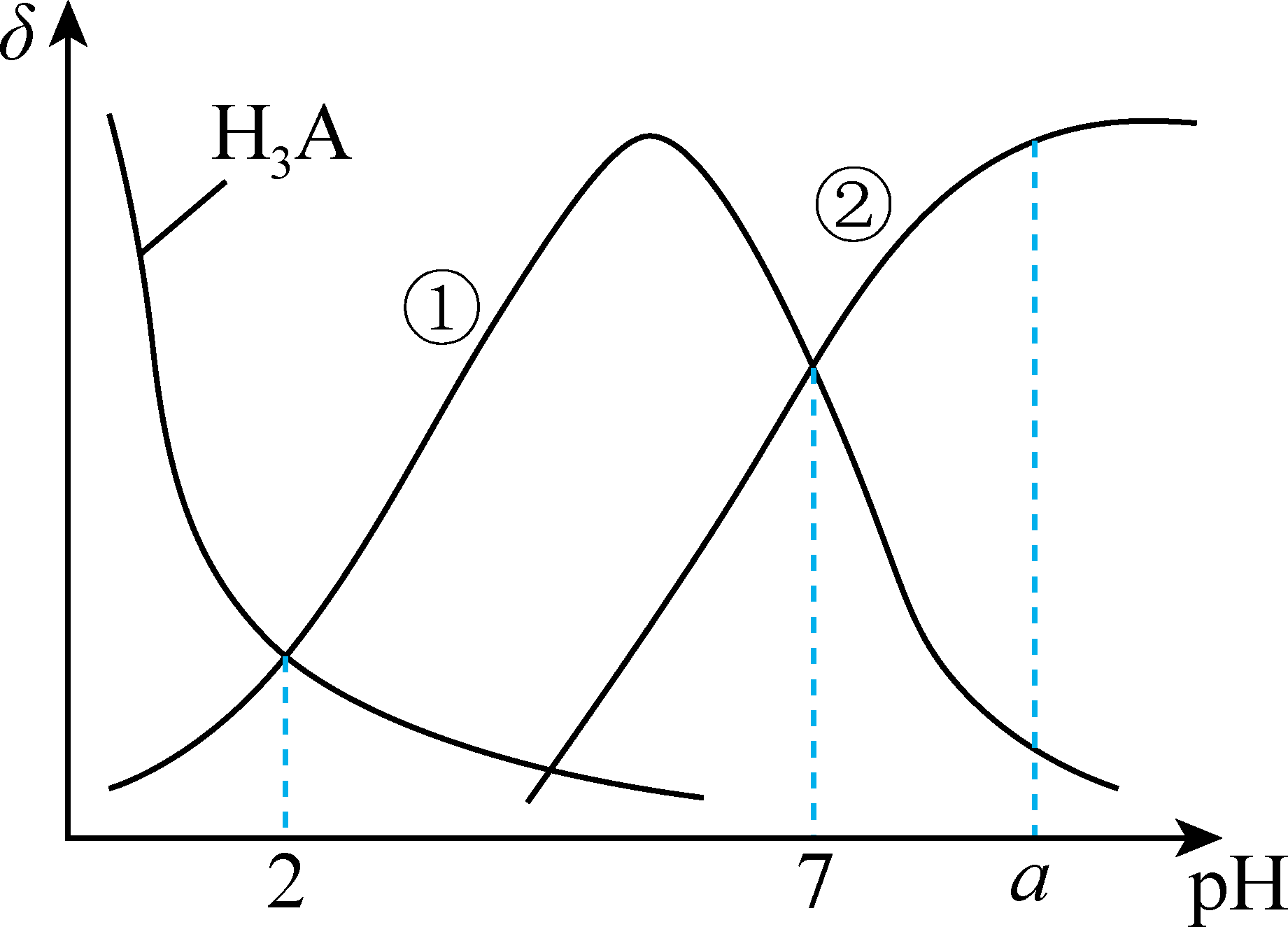
曲线①代表$\\delta \\left( \\text{H}{{\\text{A}}^{2-}} \\right)$,曲线②代表$\\delta \\left( {{\\text{H}}_{2}}{{\\text{A}}^{-}} \\right)$
","${{\\text{H}}_{3}}\\text{A}$的第三级电离:$\\text{H}{{\\text{A}}^{2-}}\\rightleftharpoons {{\\text{H}}^{+}}+{{\\text{A}}^{3-}}$
","${{\\text{H}}_{3}}\\text{A}$的电离常数${{K}_{\\text{a}1}}=1.0\\times {{10}^{-6}}$
","当所加$\\rm NaOH$溶液体积为$\\rm 40\\;\\rm mL$,${\\rm pH}=a$时,$c\\left( {{\\text{H}}_{2}}{{\\text{A}}^{-}} \\right)$约为${{10}^{6-a}}\\text{mol}\\cdot {{\\text{L}}^{-1}}$
"]$\rm A$.向$\rm H_{3}A$溶液中加入$\rm NaOH$溶液时,溶液中$\rm H_{3}A$的浓度减小,$\rm H_{2}A^{-}$和$\rm HA^{2-}$离子的浓度先增大后减小,则曲线①代表$\rm H_{2}A^{-}$分布系数、曲线②代表$\rm HA^{2-}$分布系数,故$\rm A$错误;
$\rm B$.由题意可知,$\rm H_{3}A$为三元弱酸,在溶液中分步电离,第三级电离的电离方程式为$\text{H}{{\text{A}}^{2-}}\rightleftharpoons {{\text{H}}^{+}}+{{\text{A}}^{3-}}$,故$\rm B$正确;
$\rm C$.由图可知,溶液$\rm pH$为$\rm 2$时,溶液中$\rm H_{3}A$和$\rm H_{2}A^{-}$的浓度相等,由电离常数公式可知,$\rm H_{3}A$的电离常数$K_{\rm a1}=\dfrac{{c(}{{\text{H}}_{2}}{{\text{A}}^{-}}{)c(}{{\text{H}}^{+}}\text{)}}{{c(}{{\text{H}}_{3}}\text{A)}} =c(\rm H^{+})=10^{-2}$,故$\rm C$错误;
$\rm D$.$\rm pH=7$时,$K_{a2}=\dfrac{{c(\text H}{{\text{A}}^{\text{2-}}}{)c(}{{\text{H}}^{+}}{)}}{{c(}{{\text{H}}_{2}}{{\text{A}}^{-}}\text{)}} =c(\rm H^{+})=10^{-7}$,当所加$\rm NaOH$溶液体积为$\rm 40\;\rm mL$,溶液中的溶质为$\rm Na_{2}HA$,则$ c(\rm HA^{2-})$约为$\dfrac{\text{20\;\rm mL}\times \text{0}{.3\;\rm mol}\cdot {{\text{L}}^{\text{-1}}}}{{20\;\rm mL+40\;\rm mL}}\rm =$ $\rm 0.1\;\rm mol\cdot\rm L^{-1}$,则${\rm pH}=a$时,$K_{\rm a2}=10^{-7}=\dfrac{\text{0}{.1\;\rm mol}\cdot {{\text{L}}^{\text{-1}}}\times \text{1}{{\text{0}}^{\text{-a}}}\ \text{mol}\cdot {{\text{L}}^{\text{-1}}}}{{c(}{{\text{H}}_{\text{2}}}{{\text{A}}^{-}}\text{)}}$,$c(\rm H_{2}A^{-})$约为$ 10^{6-a}\rm \ mol \cdot \rm L^{-1}$,$\rm D$正确;
故选:$\rm BD$;
对$\rm PM2.5$样本用蒸馏水处理制成待测试样。若测得该试样所含水溶性无机离子的化学组分及其平均浓度如下表$\rm ({{\text{H}}^{+}}$与$\text{O}{{\text{H}}^{-}}$未列出$\rm )$:
| 离子 | ${{\text{K}}^{+}}$ | $\text{N}{{\text{a}}^{+}}$ | $\text{NH}_{4}^{+}$ | $\text{SO}_{4}^{2-}$ | $\text{NO}_{3}^{-}$ | $\text{C}{{\text{l}}^{-}}$ |
| 浓度$\rm (\mathrm{mol} \cdot \mathrm{L}^{-1}\rm )$ | $4\times {{10}^{-6}}$ | $6\times {{10}^{-6}}$ | $2\times {{10}^{-5}}$ | $4\times {{10}^{-5}}$ | $3\times {{10}^{-5}}$ | $2\times {{10}^{-5}}$ |
根据表中数据判断$\rm PM2.5$试样的$\rm pH$值$\rm =$ 。
$\\rm 4$
"]]由电荷守恒可知,溶液中$\rm H^{+}$的浓度为$\rm (4\times 10^{-5}\times 2+3\times 10^{-5}+2\times 10^{-5})mol/L-(0.4\times 10^{-5}+0.6\times 10^{-5}+2\times 10^{-5})mol/L=10^{-4}\;\rm mol/L$,则溶液$\rm pH$为$\rm 4$。
高中 | 盐类水解常数题目答案及解析(完整版)
