高中 | 盐类水解常数 题目答案及解析
稿件来源:高途
高中 | 盐类水解常数题目答案及解析如下,仅供参考!
选修四
第三章 水溶液中的离子平衡
第三节 盐类的水解
盐类水解常数
酸及盐在生活生产中应用广泛。
甲苯氧化可生成苯甲酸。向盛有$\rm 2$ $\rm mL$甲苯的试管中,加入几滴酸性$\text{KMn}{{\text{O}}_{4}}$溶液,振荡,观察到体系颜色 。
由紫色变为无色
"]]酸性$\rm KMnO_{4}$溶液具有强氧化性,可以将甲苯氧化生成苯甲酸,故向盛有$\rm 2\;\rm mL$甲苯的试管中,加入几滴酸性$\rm KMnO_{4}$溶液,振荡,观察到体系颜色由紫色变为无色。
某苯甲酸粗品含少量泥沙和氯化钠。用重结晶法提纯该粗品过程中,需要的操作及其顺序为:加热溶解、 $\rm ($填下列操作编号$\rm )$。
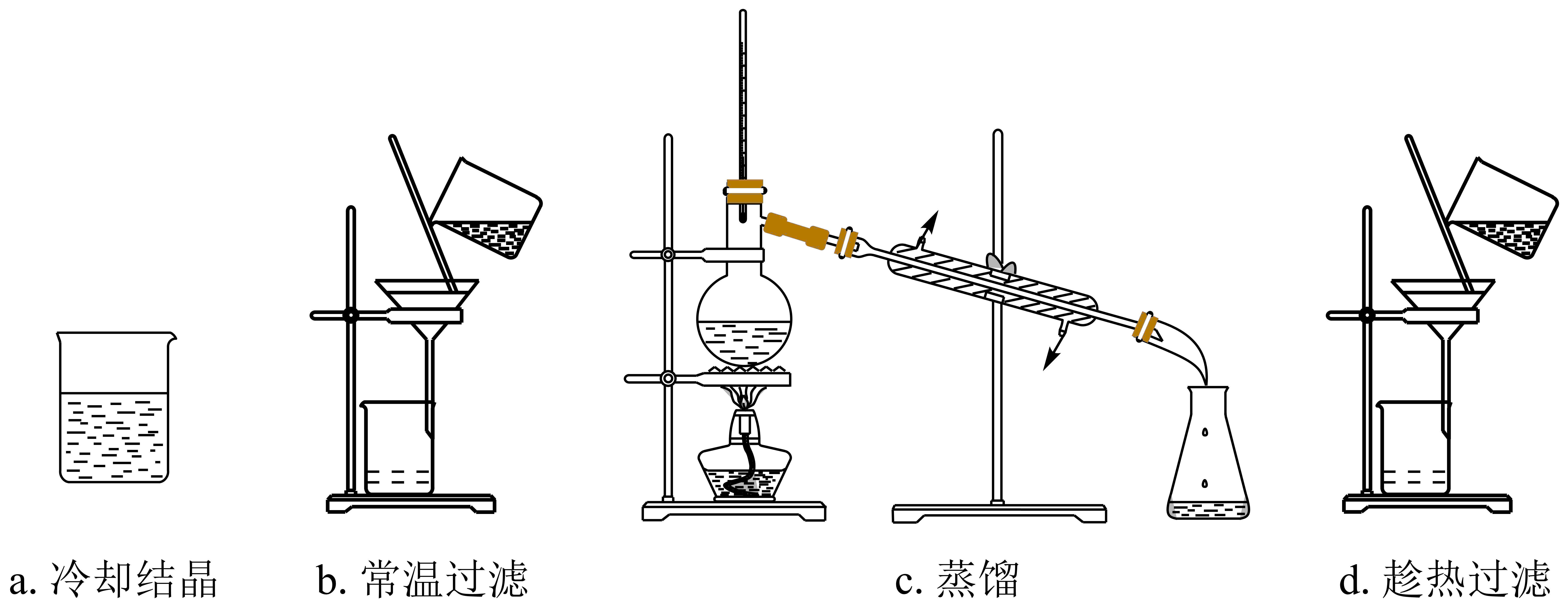
$\\rm da$
"]]重结晶法提纯苯甲酸的方法为,加热溶解、趁热过滤、冷却结晶,故操作编号为$\rm da$
兴趣小组测定常温下苯甲酸饱和溶液的浓度${{c}_{0}}$和苯甲酸的${{K}_{\text{a}}}$,实验如下:取$\rm 50.00$ $\rm mL$苯甲酸饱和溶液,用$0.1000\text{ mol}/\text{L NaOH}$溶液滴定,用$\rm pH$计测得体系的$\rm pH$随滴入溶液体积$V$变化的曲线如图。据图可得:
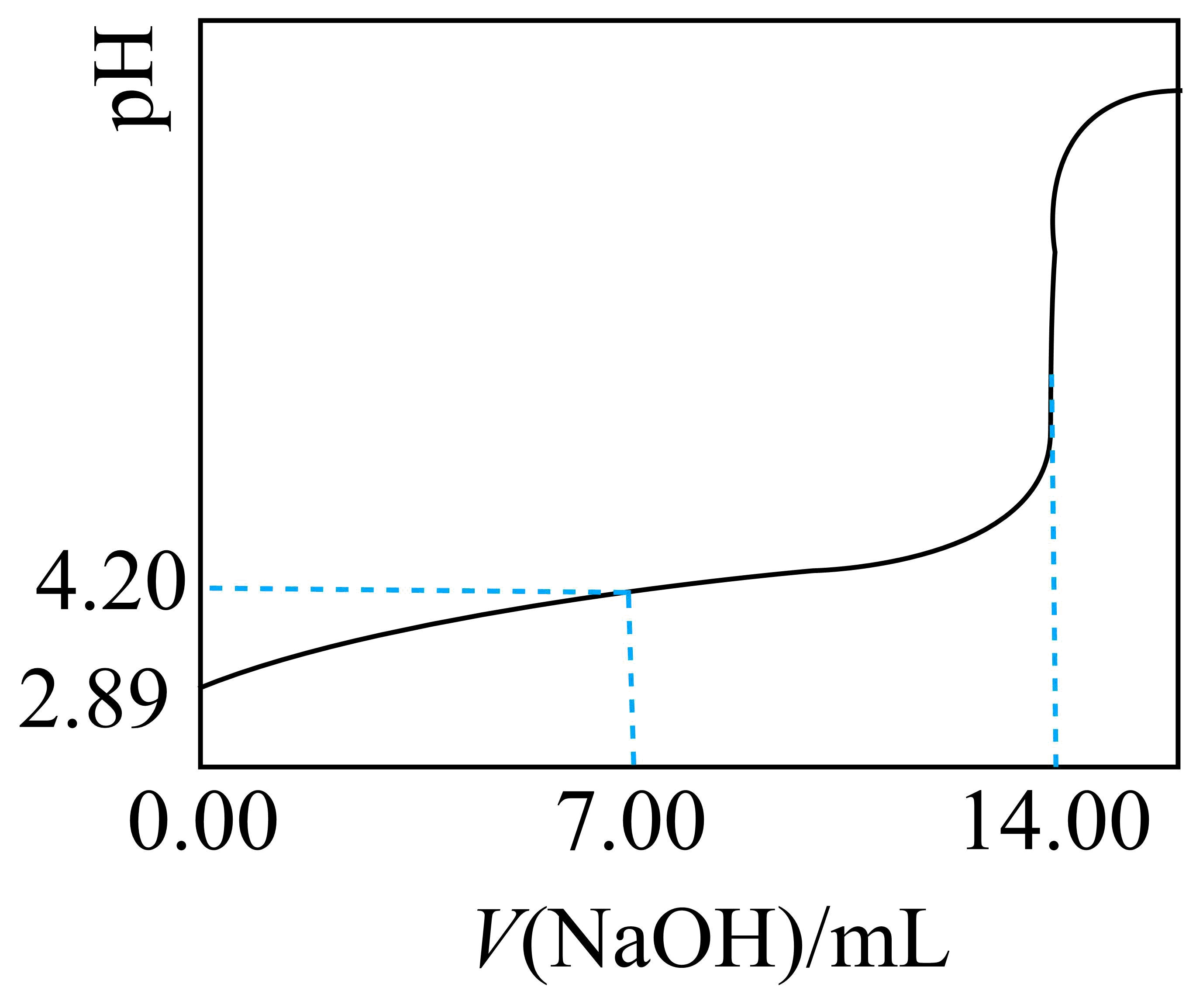
①${{c}_{0}}=$ $\;\rm \text{mol}/\text{L}$。
②苯甲酸的${{K}_{\text{a}}}=$ $\rm ($列出算式,水的电离可忽略$\rm )$。
$\\text{0}\\text{.028}$ ; ${{K}_{\\text{a}}}=\\dfrac{{{10}^{-2.89}}\\times {{10}^{-2.89}}}{0.028}$
"]]①由图像可知,当加入$\rm 14$ $\rm mL$ $\rm NaOH$溶液时,苯甲酸被完全中和,则可得苯甲酸饱和溶液的浓度${{c}_{\text{0}}}=\dfrac{\text{0}\text{.1000 mol/L}\times \text{14}\times \text{1}{{\text{0}}^{\text{-3}}}\text{ L}}{\text{50}\times \text{1}{{\text{0}}^{\text{-3}}}\text{ L}}\text{=0}\text{.028 mol/L}$;
②由图像可知,苯甲酸饱和溶液的$\rm pH$为$\rm 2.89$,说明苯甲酸饱和溶液中的$c\text{(}{{\text{H}}^{+}}\text{)=}c\text{(苯甲酸根}\text{)=1}{{\text{0}}^{\text{-2}\text{.89}}}\text{ mol/L}$,则苯甲酸的${{K}_{\text{a}}}=\dfrac{{{10}^{-2.89}}\times {{10}^{-2.89}}}{0.028}$
该小组继续探究取代基对芳香酸酸性的影响。
①知识回顾 羧酸酸性可用${{K}_{\text{a}}}$衡量。下列羧酸${{K}_{\text{a}}}$的变化顺序为:$\text{C}{{\text{H}}_{3}}\text{COOH}\lt \text{C}{{\text{H}}_{2}}\text{ClCOOH}\lt \text{CC}{{\text{l}}_{3}}\text{COOH}\lt \text{C}{{\text{F}}_{3}}\text{COOH}$。随着卤原子电负性 ,羧基中的羟基 增大,酸性增强。
②提出假设 甲同学根据①中规律推测下列芳香酸的酸性强弱顺序为:
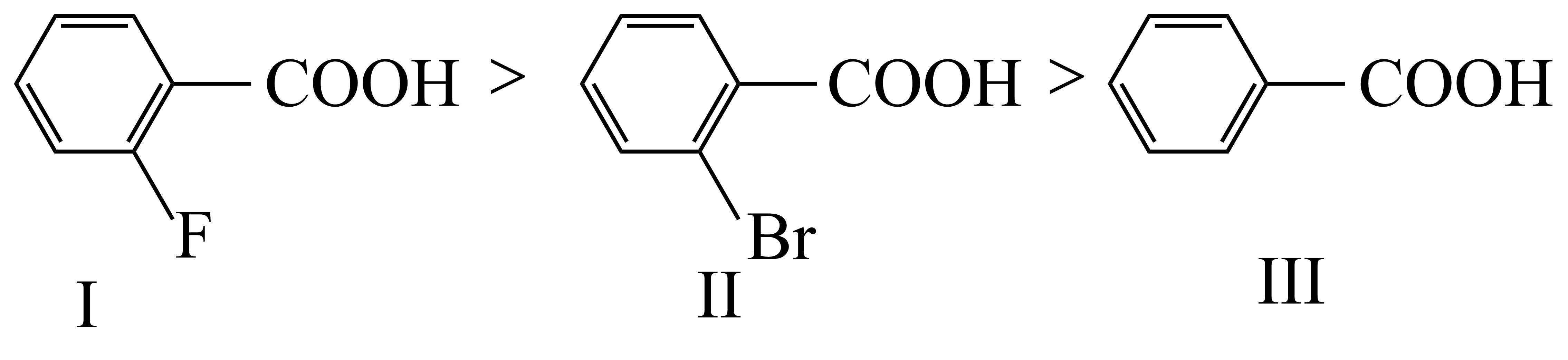
③验证假设 甲同学测得常温下三种酸的饱和溶液的$\rm pH$大小顺序为Ⅲ$\rm \gt $Ⅱ$\rm \gt $Ⅰ,据此推断假设成立。但乙同学认为该推断依据不足,不能用所测得的$\rm pH$直接判断${{K}_{\text{a}}}$大小顺序,因为 。
乙同学用$(3)$中方法测定了上述三种酸的${{K}_{\text{a}}}$,其顺序为Ⅱ$\rm \gt $Ⅰ$\rm \gt $Ⅲ。
④实验小结 假设不成立,芳香环上取代基效应较复杂,①中规律不可随意推广。
增大 ; 极性 ; 常温下三种酸的饱和溶液的浓度不同
"]]①羧酸酸性的强弱取决于羧基中$\rm O-H$键的极性大小,极性越大,酸性越强,卤素原子的电负性越大,吸电子能力越强,使得羧基中$\rm O-H$键的极性越大,酸性越强;
③由于常温下三种酸的饱和溶液的浓度不同,所以该推断依据不足。
该小组尝试测弱酸$\rm HClO$的${{K}_{\text{a}}}$。
①丙同学认为不宜按照$(3)$中方法进行实验,其原因之一是次氯酸易分解。该分解反应的离子方程式为 。
②小组讨论后,选用$\rm 0.100$ $\rm mol/L$ $\rm NaClO$溶液$\rm ($含少量$\rm NaCl)$进行实验,以获得$\rm HClO$的${{K}_{\text{a}}}$。简述该方案 $\rm ($包括所用仪器及数据处理思路$\rm )$。
③教师指导:设计实验方案时,需要根据物质性质,具体问题具体分析。
$\\text{2HClO}\\begin{matrix} \\underline{\\underline{光照}} \\\\ {} \\\\\\end{matrix}\\text{2}{{\\text{H}}^{+}}\\text{+2C}{{\\text{l}}^{-}}+{{\\text{O}}_{\\text{2}}}\\uparrow $ ; 实验方法:取适量$\\rm 0.100\\;\\rm mol/L$ $\\rm NaClO$溶液放入烧杯中,用$\\rm pH$计测得体系在$\\rm 25$ $\\rm ^\\circ\\rm C$下的$\\rm pH$,记录数据;
数据处理思路:由于$\\rm NaClO$溶液中存在$\\rm ClO^{-}$的水解,故根据$\\rm 0.100$ $\\rm mol/L$ $\\rm NaClO$溶液在$\\rm 25$ $\\rm ^\\circ\\rm C$下的$\\rm pH$可求得$\\rm ClO^{-}$的水解平衡常数${{K}_{\\text{h}}}$,再利用公式${{K}_{\\text{a}}}=\\dfrac{{{K}_{\\text{W}}}}{{{K}_{\\text{h}}}}$求出$\\rm HClO$的${{K}_{\\text{a}}}$。
"]]①次氯酸在光照条件下易分解为$\rm HCl$和$\rm O_{2}$,其分解反应的离子方程式为$\text{2HClO}\begin{matrix} \underline{\underline{光照}} \\ {} \\\end{matrix}\text{2}{{\text{H}}^{+}}\text{+2C}{{\text{l}}^{-}}+{{\text{O}}_{\text{2}}}\uparrow $;
②实验方法:取适量$\rm 0.100\;\rm mol/L$ $\rm NaClO$溶液放入烧杯中,用$\rm pH$计测得体系在$\rm 25$ $\rm ^\circ\rm C$下的$\rm pH$,记录数据;
数据处理思路:由于$\rm NaClO$溶液中存在$\rm ClO^{-}$的水解,故根据$\rm 0.100$ $\rm mol/L$ $\rm NaClO$溶液在$\rm 25$ $\rm ^\circ\rm C$下的$\rm pH$可求得$\rm ClO^{-}$的水解平衡常数${{K}_{\text{h}}}$,再利用公式${{K}_{\text{a}}}=\dfrac{{{K}_{\text{W}}}}{{{K}_{\text{h}}}}$求出$\rm HClO$的${{K}_{\text{a}}}$。
高中 | 盐类水解常数题目答案及解析(完整版)
