高中 | 金属钠 题目答案及解析
稿件来源:高途
高中 | 金属钠题目答案及解析如下,仅供参考!
必修一
第三章 金属及其化合物
第一节 金属的化学性质
金属钠
下表标出的是元素周期表的一部分元素:
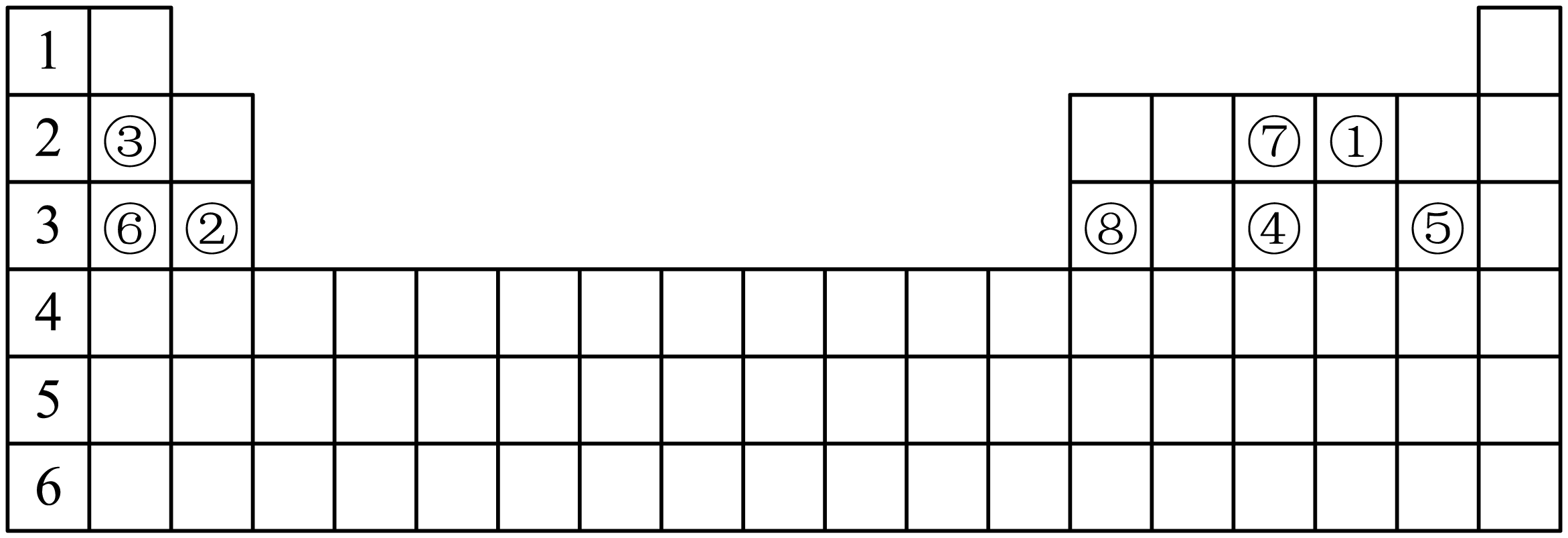
根据上表回答下列问题:
元素⑧的原子序数是 ,其在周期表中的位置是 。
$\\rm 13$;第三周期第Ⅲ$\\rm A$族
"]]⑧是$\rm Al$元素,$\rm Al$是$\rm 13$号元素,$\rm Al$原子核外电子排布是$\rm 2$、$\rm 8$、$\rm 3$,根据原子结构与元素位置关系可知$\rm Al$位于元素周期表第三周期第Ⅲ$\rm A$族;
元素④与⑦相比, 元素的原子半径较大$\rm ($用元素符号填写,下同$\rm )$, 元素的氢化物更稳定。
$\\rm P$;$\\rm N$
"]]元素④是$\rm P$,元素⑦是$\rm N$,二者是同一主族元素,原子核外电子层数越多,原子半径就越大,所以原子半径:$\rm P\gt N$;
原子核外电子层数越少,元素的非金属性就越强,则元素的非金属性:$\rm N\gt P$;由于元素的非金属性越强,其形成的简单氢化物的稳定性就越强。则氢化物的稳定性:$\rm NH_{3}\gt PH_{3}$,所以$\rm N$元素的氢化物$\rm NH_{3}$的稳定性更强;
⑦的单质与氢气反应的化学方程式为 。
$\\rm N_{2}+3H_{2} \\overset{ 高温高压}{\\underset{ 催化剂}{\\rightleftharpoons}} 2NH_{3} $
"]]⑦是$\rm N$,$\rm N$元素的单质$\rm N_{2}$与$\rm H_{2}$在高温高压催化剂存在条件下反应产生$\rm NH_{3}$,该反应为可逆反应,反应的化学方程式为:$\rm N_{2}+3H_{2} \overset{ 高温高压}{\underset{ 催化剂}{\rightleftharpoons}} 2NH_{3} $;
元素③与⑥相比,最高价氧化物对应水化物碱性较大的是 $\rm ($填碱的化学式$\rm )$。元素⑥的单质与冷水反应的化学方程式为 。
$\\rm NaOH$;$\\rm 2Na+2H_{2}O=2NaOH+H_{2}↑$
"]]③是$\rm Li$,⑥是$\rm Na$,二者是同一主族元素,从上到下元素的金属性逐渐增强,则其最高价氧化物对应的水化物的碱性就越强,因此元素的金属性$\rm Na\gt Li$,因此碱性:$\rm NaOH\gt LiOH$,即$\rm NaOH$的碱性更强;
⑥是$\rm Na$,金属$\rm Na$与冷水剧烈反应产生$\rm NaOH$、$\rm H_{2}$,反应的化学方程式为:$\rm 2Na+2H_{2}O=2NaOH+H_{2}↑$;
在有助熔剂的情况下,电解⑧的氧化物可以得到对应的单质,化学方程式为 。
$\\rm 2Al_{2}O_{3 }\\begin{array}{*{20}{c}}{\\underline{\\underline {电解}} }\\\\助溶剂{}\\end{array}4Al+3O_{2}↑$
"]]⑧是$\rm Al$元素,在有助熔剂的情况下,电解熔融$\rm Al_{2}O_{3}$可以得到对应的单质,相应反应的化学方程式为:$\rm 2Al_{2}O_{3 }\begin{array}{*{20}{c}}{\underline{\underline {电解}} }\\助溶剂{}\end{array}4Al+3O_{2}↑$;
如图,将潮湿的元素⑤构成的单质通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是$(\quad\ \ \ \ )$。
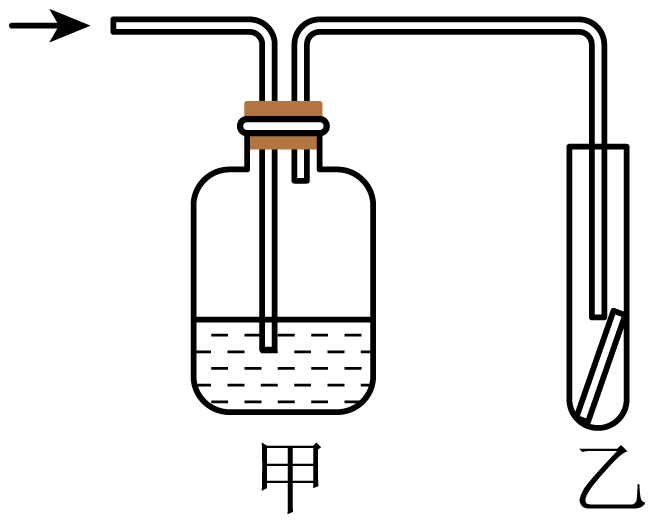
稀硫酸
","浓硫酸
","水
","饱和食盐水
"]⑤是$\rm Cl$,潮湿的$\rm Cl_{2}$具有漂白性,干燥的$\rm Cl_{2}$不具有漂白性。将潮湿的$\rm Cl_{2}$通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试剂可能是是浓硫酸,将$\rm Cl_{2}$干燥,使其失去漂白性,也可能是将$\rm Cl_{2}$吸收,不能得到$\rm Cl_{2}$而失去漂白性,则该试剂可能是浓硫酸,故合理选项是$\rm B$。
高中 | 金属钠题目答案及解析(完整版)
