高中 | 化学键 题目答案及解析
稿件来源:高途
高中 | 化学键题目答案及解析如下,仅供参考!
必修二
第一章 物质结构 元素周期律
第三节 化学键
化学键
$\rm M$、$\rm N$、$\rm Z$、$\rm Y$、$\rm X$、$\rm T$是原子半径依次增大的前$\rm 10$号元素,基态$\rm N$原子核外电子有$\rm 5$种空间运动状态,并有$\rm 1$个单电子,这六种元素形成的一种化合物结构如图所示。$\rm (\qquad)$
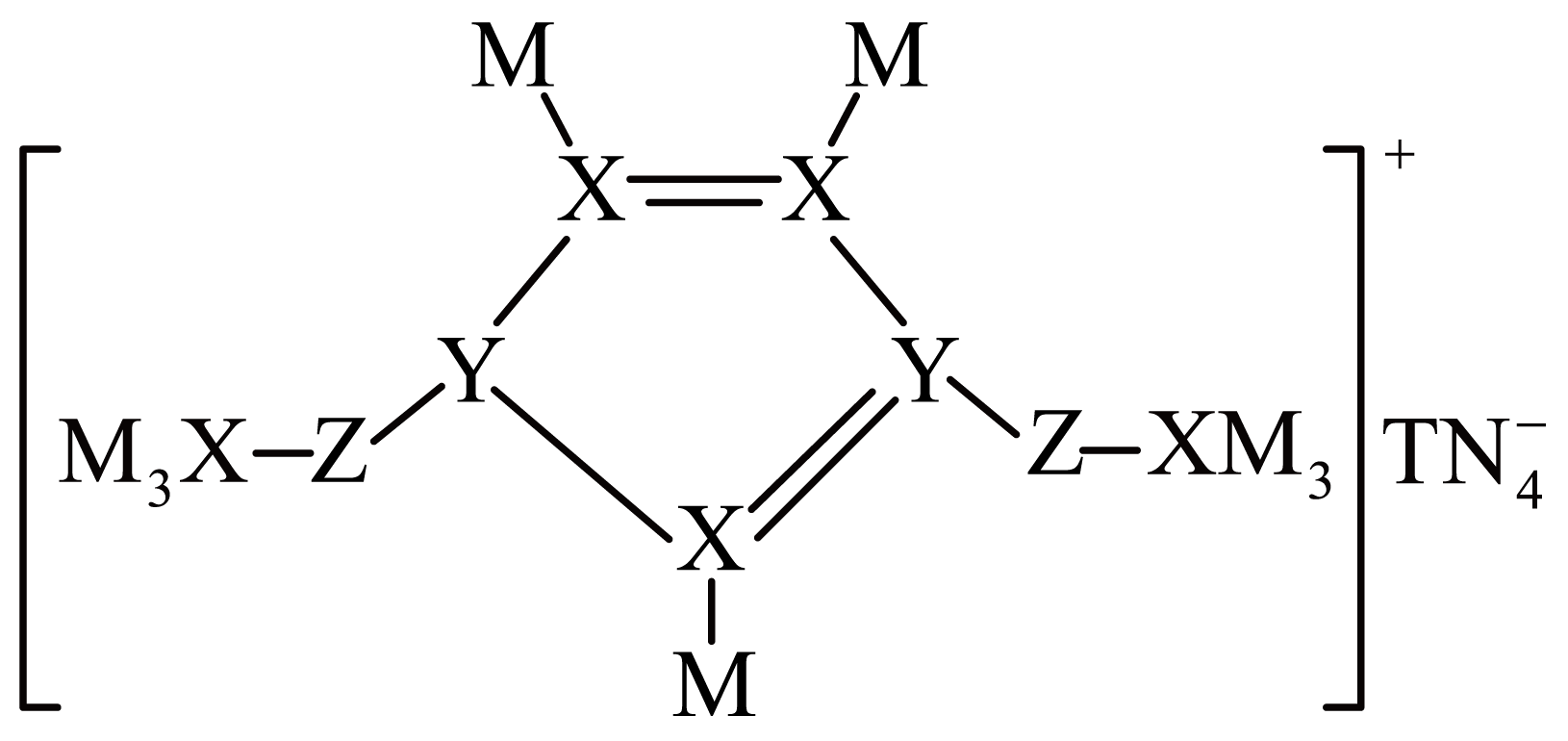
与$\\rm Z$同周期且第一电离能大于$\\rm Z$的元素有$\\rm 2$种
","该化合物中只含有离子键、共价键,不存在配位键
","六种元素中,$\\rm X$的最高价含氧酸的酸性最强
","最简单氢,化物的沸点为$\\rm X\\lt N\\lt Z$
"]基态$\rm N$原子核外电子有$\rm 5$种空间运动状态,并有$\rm 1$个单电子,推测$\rm N$元素为$\rm F$元素,结合物质的结构图可知$\rm M$只能形成一个共价键且原子半径比$\rm F$小推测为$\rm H$,$\rm Z$形成$\rm 2$个共价键且半径比$\rm F$大推测为$\rm O$元素,$\rm Y$形成$\rm 3$个共价键且半径比$\rm F$大推测为$\rm N$元素,$\rm X$形成$\rm 4$个共价键且半径比$\rm F$大推测为$\rm C$元素,$\rm T$与$\rm F$形成$\rm TN_{4}^{-}$,推测为$\rm B$元素,综合分析,$\rm X$为$\rm C$、$\rm Y$为$\rm N$、$\rm Z$为$\rm O$、$\rm M$为$\rm H$、$\rm T$为$\rm B$、$\rm N$为$\rm F$。
$\rm A$.$\rm Z$为$\rm O$,同周期元素,从左到右,第一电离能增大,但$\rm VA$元素第一电离能大于Ⅵ$\rm A$元素的第一电离能,则稀有气体$\rm Ne$及$\rm Cl$、$\rm N$的第一电离能大于$\rm O$,故$\rm A$错误。
$\rm B$.该化合物中有阴、阳离子,存在离子键,阳离子内部原子之间以共价键相连,阴离子内部存在配位键,故$\rm B$错误。
$\rm C$.最高价含氧酸的酸性强弱可以通过元素的非金属性强弱来比较,氟元素的非金属性最强,但是氟元素没有含氧酸,氧元素没有最高正价,所以上述元素中氮元素的最高价含氧酸酸性最强,故$\rm C$错误。
$\rm D$.物质含有氢键,沸点增大,常温下,$\rm H_{2}O$为液态,$\rm HF$为气体,则水的沸点高于$\rm HF$,$\rm HF$分子内含有氢键,则沸点高于$\rm CH_{4}$,故$\rm D$正确。
故选:$\rm D$
高中 | 化学键题目答案及解析(完整版)
