高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
$\text{DMFC}$成为非常有前途的固定式和便携式的可持续能源转换存储设备,即在负极直接通入甲醇燃料替代氢气。反应原理如图所示,下列说法错误的是$(\qquad)$
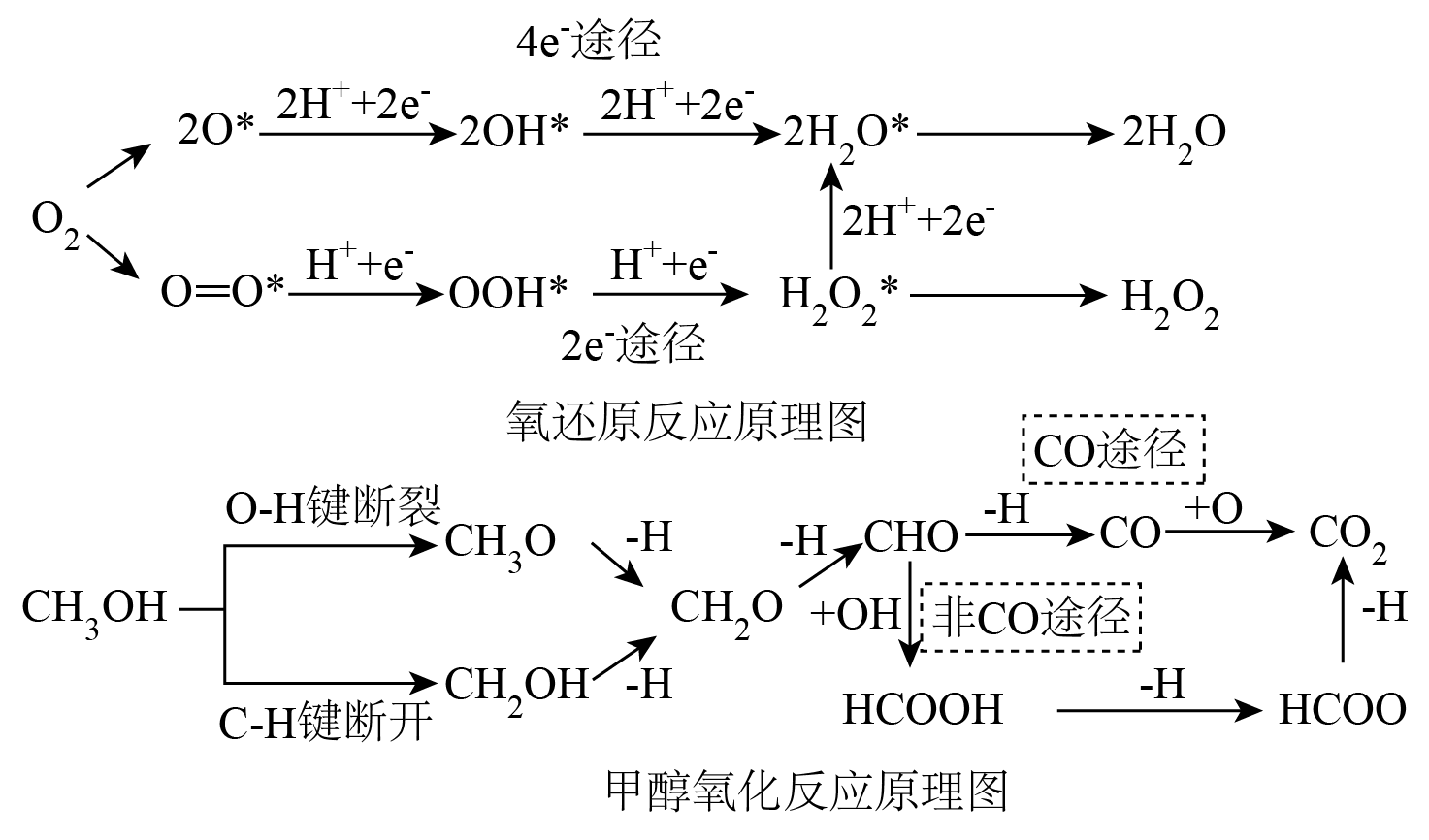
甲醇氧化反应过程中只涉及极性键的断裂和形成
","甲醇、甲酸、水、过氧化氢中的氧原子均为$\\text{s}{{\\text{p}}^{3}}$杂化
","若氧还原反应主要按照$4{{\\text{e}}^{-}}$途径进行,则$\\text{DMFC}$的总反应为$2\\text{C}{{\\text{H}}_{3}}\\text{OH}+3{{\\text{O}}_{2}}=2\\text{C}{{\\text{O}}_{2}}+4{{\\text{H}}_{2}}\\text{O}$
","氧气在$2{{\\text{e}}^{-}}$途径发生反应的方程式:${{\\text{O}}_{2}}+2{{\\text{H}}^{+}}+2{{\\text{e}}^{-}}={{\\text{H}}_{2}}{{\\text{O}}_{2}}$
"]$\rm A$.甲醇氧化反应过程中涉及到$\rm H-O$键断开和碳氧键生成,都是极性键,$\rm A$正确;
$\rm B$.甲酸中羧基的氧原子一个为$\rm sp^{3}$杂化,另一个是$\rm sp^{2}$杂化,$\rm B$错误;
$\rm C$.若氧还原反应主要按照$4{{\text{e}}^{-}}$途径进行,$\rm O_{2}$最终生成$\rm H_{2}O$,甲醇生成$\rm CO_{2}$,总反应方程式为:$2\text{C}{{\text{H}}_{3}}\text{OH}+3{{\text{O}}_{2}}=2\text{C}{{\text{O}}_{2}}+4{{\text{H}}_{2}}\text{O}$,$\rm C$正确;
$\rm D$.氧气在$2{{\text{e}}^{-}}$途径最终生成$\rm H_{2}O_{2}$,发生反应的方程式:${{\text{O}}_{2}}+2{{\text{H}}^{+}}+2{{\text{e}}^{-}}={{\text{H}}_{2}}{{\text{O}}_{2}}$,$\rm D$正确。
故选:$\rm B$
高中 | 杂化轨道理论题目答案及解析(完整版)
