高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
铜及其化合物用途广泛。回答下列问题:
$\rm Cu$在元素周期表中位于第 周期第 族;基态$\text{C}{{\text{u}}^{2+}}$核外有 个未成对电子。
四 ; $\\rm IB$ ; $\\rm 1$
"]]$\rm Cu$为$\rm 29$号元素,在元素周期表中位于第四周期第$\rm IB$族;基态$\rm Cu$原子的价电子排布式为$3{{\text{d}}^{10}}4{{\text{s}}^{1}}$,基态$\text{C}{{\text{u}}^{2+}}$的价电子排布式为$3{{\text{d}}^{9}}$,则基态$\text{C}{{\text{u}}^{2+}}$核外有$\rm 1$个未成对电子。
蓝矾的简单结构如图$\rm 1$。
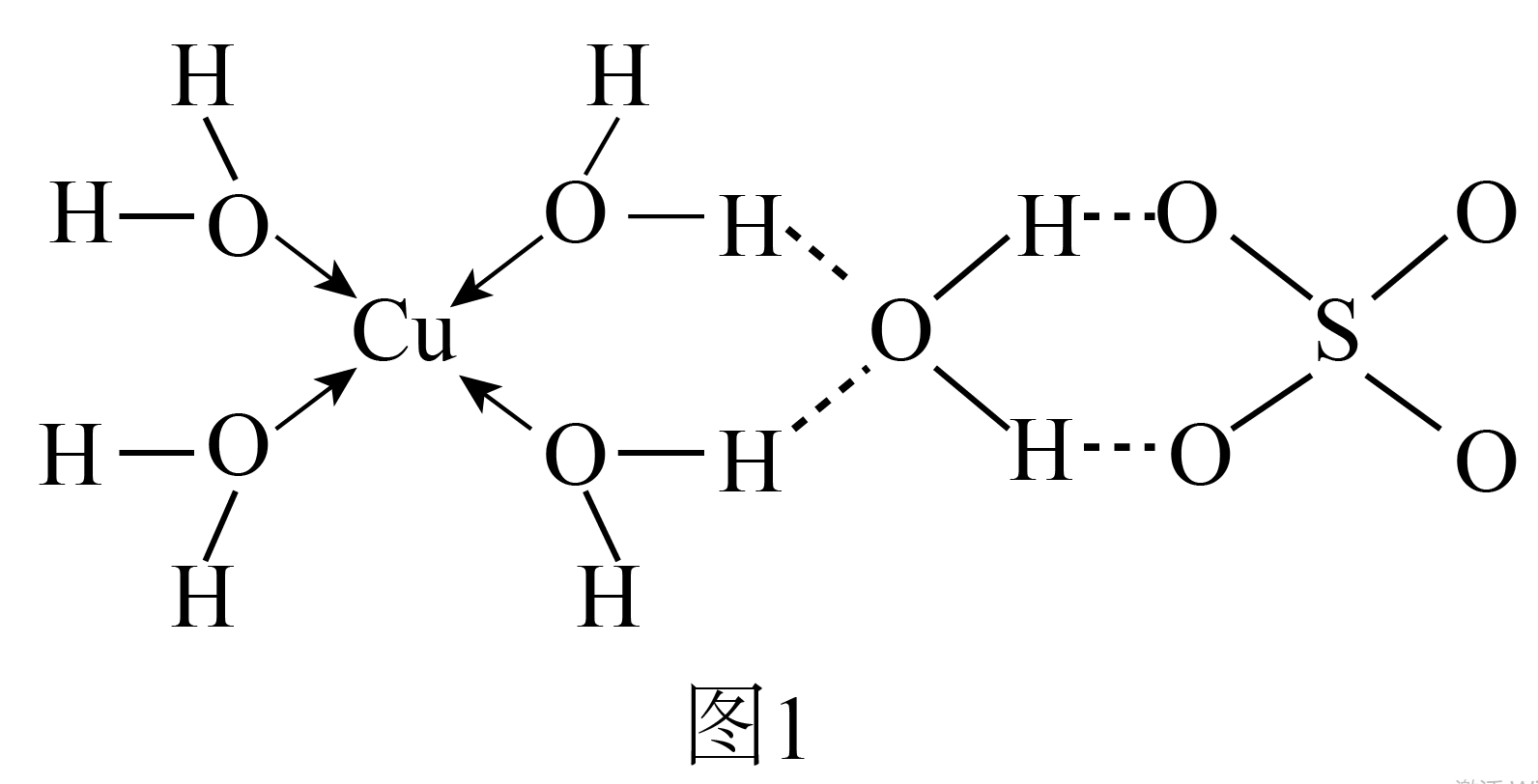
蓝矾晶体中形成配位键时 提供空轨道。$\text{SO}_{4}^{2-}$的空间结构为 。蓝矾晶体中形成配位键的${{\text{H}}_{2}}\text{O}$分子的$\rm H-O-H$键角 $\rm ($填“$\rm \gt $”“$\rm =$”或“$\rm \lt $”$\rm )104.5^\circ$。
$\\text{C}{{\\text{u}}^{2+}}$ ; 正四面体 ; $\\rm \\gt $
"]]由蓝矾的结构可知,其晶体可表示为$\left[ \text{Cu}{{\left( {{\text{H}}_{2}}\text{O} \right)}_{4}} \right]\text{S}{{\text{O}}_{4}}\cdot {{\text{H}}_{2}}\text{O}$,晶体中含$\text{Cu}-\text{O}$配位键,其中$\rm O$提供孤电子对,$\text{C}{{\text{u}}^{2+}}$提供空轨道。$\text{SO}_{4}^{2-}$的中心原子$\rm S$的$\rm \sigma$键为$\rm 4$,孤电子对数为$\dfrac{6+2-2\times 4}{2}=0$,中心$\rm S$原子采取$\text{s}{{\text{p}}^{3}}$杂化,$\text{SO}_{4}^{2-}$的空间结构为正四面体。水分子中的$\text{H}-\text{O}-\text{H}$键角为${{104.5}^{{}^\circ }}$,蓝矾晶体中形成配位键的水分子的孤电子对参与成键,成键电子对之间的斥力小于水中孤电子对对成键电子对的斥力,蓝矾晶体中形成配位键的${{\text{H}}_{2}}\text{O}$分子的$\rm H-O-H$键角大于$\rm 104.5^\circ$。
二维导电金属$\rm -$有机框架$\rm (MOFs)$因其在超级电容器、电化学传感器、电催化剂和电池等方面的潜在应用而受到越来越多的关注。合成$\rm MOFs$的一种方法如下。
 $\cdot 3\text{HCl}+\text{Cu}{{\left( \text{N}{{\text{O}}_{3}} \right)}_{2}}\cdot 3{{\text{H}}_{2}}\text{O}$
$\cdot 3\text{HCl}+\text{Cu}{{\left( \text{N}{{\text{O}}_{3}} \right)}_{2}}\cdot 3{{\text{H}}_{2}}\text{O}$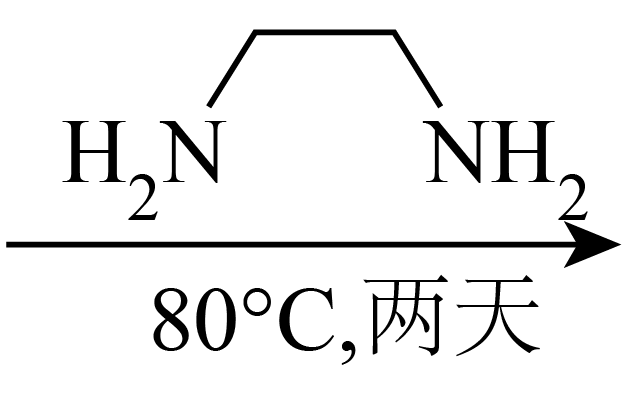 $\rm MOFs$
$\rm MOFs$
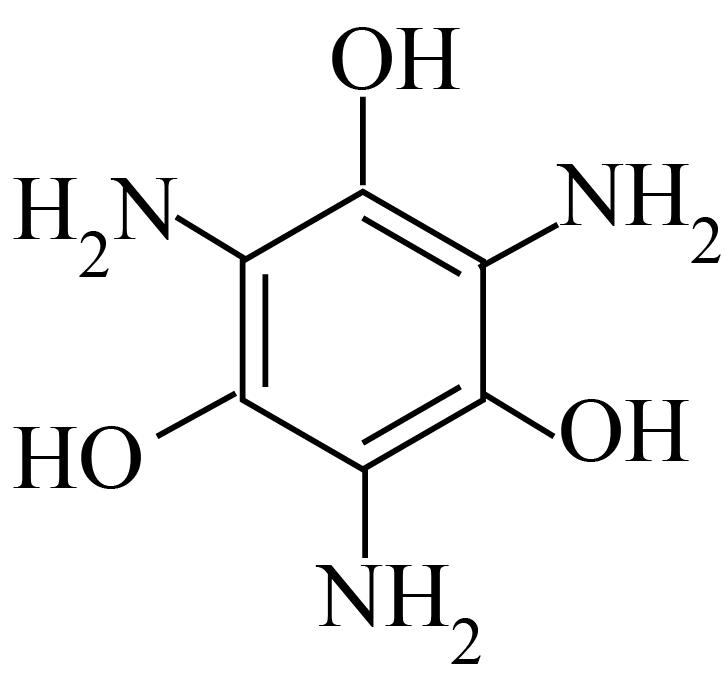
固态 $\cdot 3\text{HCl}$的晶体类型是 。
$\cdot 3\text{HCl}$的晶体类型是 。![]() 中$\rm N$原子的杂化方式是 。
中$\rm N$原子的杂化方式是 。
离子晶体 ; $\\text{s}{{\\text{p}}^{3}}$
"]] $\cdot\!\!\text{ 3HCl}$类似于$\text{N}{{\text{H}}_{4}}\text{Cl}$,属于离子晶体。${{\text{H}}_{2}}\text{NC}{{\text{H}}_{2}}\text{C}{{\text{H}}_{2}}\text{N}{{\text{H}}_{2}}$分子的氨基中$\rm N$原子为$\text{s}{{\text{p}}^{3}}$杂化。
$\cdot\!\!\text{ 3HCl}$类似于$\text{N}{{\text{H}}_{4}}\text{Cl}$,属于离子晶体。${{\text{H}}_{2}}\text{NC}{{\text{H}}_{2}}\text{C}{{\text{H}}_{2}}\text{N}{{\text{H}}_{2}}$分子的氨基中$\rm N$原子为$\text{s}{{\text{p}}^{3}}$杂化。
一种含铜的多元金属硫化物的晶胞结构为四方晶系,已知金属原子均呈四面体配位,晶胞棱边夹角均为$\rm 90^\circ$,其结构可看作是由两个立方体$\rm A$、$\rm B$上下堆叠而成。图$\rm 2$为$\rm A$沿体对角线的投影图,图$\rm 3$为$\rm B$沿$y$轴方向的投影图。$\rm A$中$\rm Fe$、$\rm Sn$位置互换即为 $\rm B$.立方体$\rm A$、$\rm B$棱长均为$a\text{ pm}$,晶胞中部分原子的分数坐标为$\rm S(0$,$\rm 0$,$\rm 0)$、$\rm Fe\left( \dfrac{3}{4},\dfrac{1}{4},\dfrac{1}{8} \right)$。
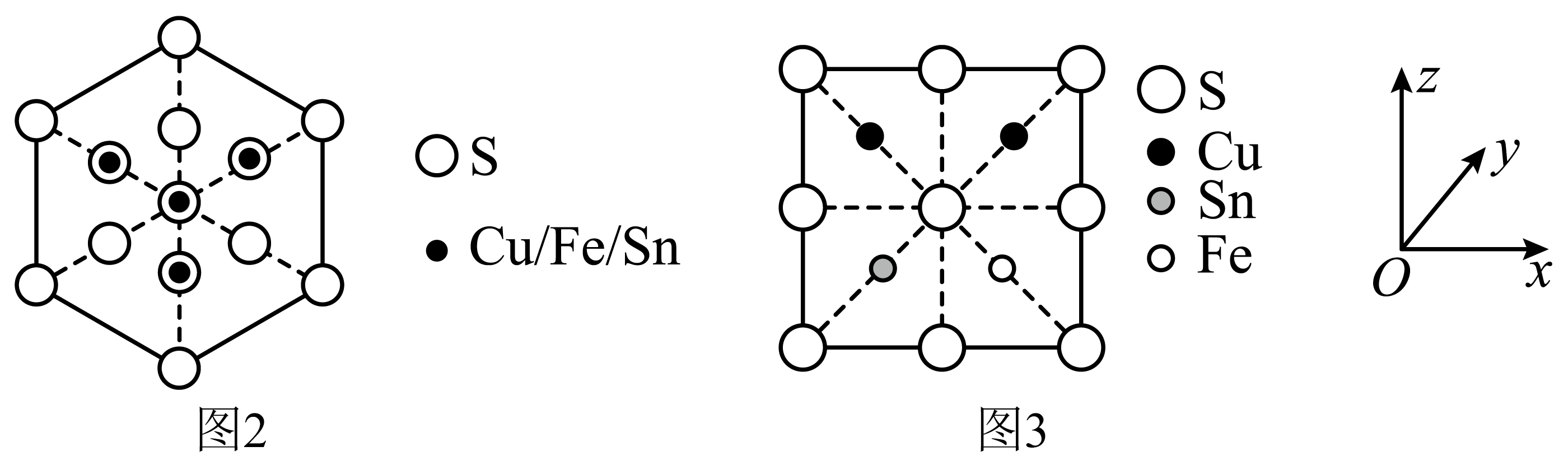
晶胞中$\rm Sn$原子的分数坐标为 。若该晶体的密度为$d\,\text{g}\cdot \text{c}{{\text{m}}^{-3}}$,则阿伏加德罗常数${{{N}}_{\text{A}}}=$ 。
$\\left( \\dfrac{1}{4},\\dfrac{3}{4},\\dfrac{1}{8} \\right)$,$\\left( \\dfrac{3}{4},\\dfrac{1}{4},\\dfrac{5}{8} \\right)$ ; $\\dfrac{4.31 \\times 10^{32}}{a^3 d} \\mathrm{ mol}^{-1}$
"]]根据题意分析该晶体采用面心立方最密堆积,$\rm S$原子位于立方体$\rm A$、$\rm B$的顶点和面心,$\text{Cu}$、$\text{Fe}$、$\text{Sn}$位于体内,$\rm 1$个晶胞中含$\rm S$原子个数为$8\times \dfrac{1}{8}+10\times \dfrac{1}{2}+4\times \dfrac{1}{4}+1=8$,$\text{Cu}$原子个数为$\rm 4$,$\text{Fe}$原子个数为$\rm 2$,$\rm Sn$原子个数为$\rm 2$,因此该晶体的化学式为$\text{C}{{\text{u}}_{2}}\text{FeSn}{{\text{S}}_{4}}$,$\rm B$在下面,根据图$\rm 3$可以确定$\rm B$中$\rm Sn$原子的分数坐标为$\left( \dfrac{1}{4},\dfrac{3}{4},\dfrac{1}{8} \right)$,则$\rm A$中$\rm Sn$原子的分数坐标为$\left( \dfrac{3}{4},\dfrac{1}{4},\dfrac{5}{8} \right)$,晶体的密度$d=\dfrac{\left( 64\times 4+56\times 2+119\times 2+32\times 8 \right)\,\,\text{g}\cdot \text{mo}{{\text{l}}^{-1}}}{{{N}_{\text{A}}}\times 2{{a}^{3}}\times {{10}^{-30}}\,\,\text{c}{{\text{m}}^{-3}}}$,则${{N}_{\text{A}}}=\dfrac{4.31\times {{10}^{32}}}{{{a}^{3}}d}\,\text{mo}{{\text{l}}^{-1}}$。
高中 | 杂化轨道理论题目答案及解析(完整版)
