高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
物质结构决定物质的性质,下列性质差异与结构因素匹配正确的是$(\quad\ \ \ \ )$
| 性质差异 | 结构因素 | |
| $\rm A$. | 酸性:$\text{HCl}\lt \text{HBr}$ | 非金属性 |
| $\rm B$. | 与钠反应的剧烈程度:${{\text{H}}_{2}}\text{O}\gt {{\text{C}}_{2}}{{\text{H}}_{5}}\text{OH}$ | 羟基的极性 |
| $\rm C$. | 键角:$\text{C}{{\text{H}}_{4}}\left( 109.5{}^\circ \right)\gt \text{N}{{\text{H}}_{3}}\left( 107.3{}^\circ \right)$ | 中心原子的杂化方式 |
| $\rm D$. | 熔点: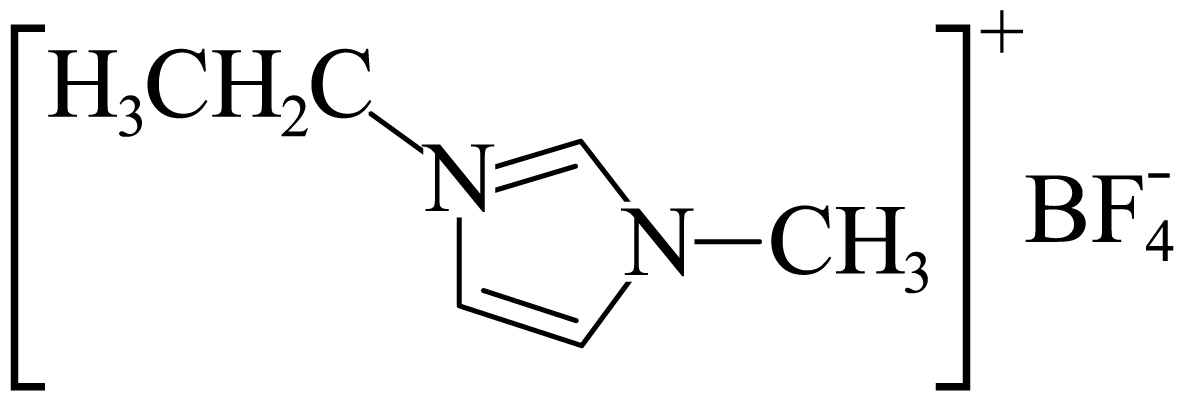 $\rm \lt NaBF_{4}$ $\rm \lt NaBF_{4}$ | 晶体类型 |
["
$\\rm A$
","$\\rm B$
","$\\rm C$
","$\\rm D$
"][["B"]]
$\rm A$.可以通过比较简单氢化物的稳定性,或最高价氧化物对应水化物的酸性来比较元素非金属性,不能用非金属性解释酸性:$\text{HCl}\lt \text{HBr}$,$\rm A$错误;
$\rm B$.甲基是推电子基团,水中羟基的极性大于乙醇,则水中羟基$\rm H$原子的活性比乙醇中羟基$\rm H$原子活性大,故钠与水反应比与乙醇反应剧烈,$\rm B$正确;
$\rm C$.$\text{C}{{\text{H}}_{4}}\text{N}{{\text{H}}_{3}}$的中心原子价层电子对数都是$\rm 4$,中心原子的杂化方式都是$\rm sp^{3}$杂化,二者键角不同是因为后者中心原子有$\rm 1$个孤电子对,孤电子对对成键电子对的排斥使其键角减小,$\rm C$错误;
$\rm D$. 与$\rm NaBF_{4}$均为离子晶体,二者熔点不同,与构成其晶体的离子半径有关,
与$\rm NaBF_{4}$均为离子晶体,二者熔点不同,与构成其晶体的离子半径有关,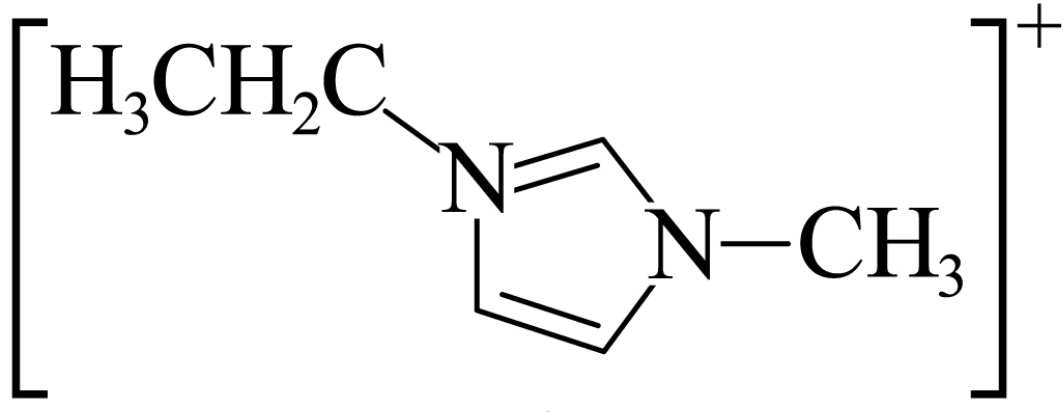 的半径大于$\rm Na^{+}$,
的半径大于$\rm Na^{+}$, 中离子键键能较小,熔点较低,与晶体类型无关,$\rm D$错误;
中离子键键能较小,熔点较低,与晶体类型无关,$\rm D$错误;
故选:$\rm B$
高中 | 杂化轨道理论题目答案及解析(完整版)
去刷题
今日推荐 ![]()
![]()
![]()
