高中 | 配合物理论 题目答案及解析
稿件来源:高途
高中 | 配合物理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
配合物理论
氟元素在医疗、生活和工业等多个领域发挥着重要作用。请回答:
Ⅶ$\rm A$族元素又称为卤族元素,下列关于卤族元素的表达中正确的是$(\quad\ \ \ \ )$。
$\\rm F$、$\\rm Cl$、$\\rm Br$、$\\rm I$第一电离能逐渐减小
","基态溴原子核外电子排布式:$\\left[ \\text{Ar} \\right]4{{\\text{s}}^{2}}4{{\\text{p}}^{5}}$
","微粒半径比较:$r\\left( \\text{C}{{\\text{l}}^{-}} \\right)\\gt r\\left( \\text{Cl} \\right)\\gt r\\left( \\text{C}{{\\text{l}}^{+}} \\right)$
","$\\text{ClO}_{3}^{-}$的$\\rm VSEPR$模型为平面三角形
"]$\rm A$.元素周期表中同主族元素从上到下,元素第一电离能逐渐减小,则$\rm F$、$\rm Cl$、$\rm Br$、$\rm I$第一电离能逐渐减小,$\rm A$正确;
$\rm B$.溴为$\rm 35$号元素,则基态溴原子核外电子排布式$\rm \left[ Ar \right]3{{\text{d}}^{10}}4{{\text{s}}^{2}}4{{\text{p}}^{5}}$,$\rm B$错误;
$\rm C$.同种元素的阴离子半径大于原子半径,原子半径大于阳离子半径,则微粒半径$ {r}\left( \rm C{{l}^{-}} \right)\gt {r}\left(\rm Cl \right)\gt {r}\left(\rm C{{l}^{+}} \right)$,$\rm C$正确;
$\rm D$.$\text{ClO}_{3}^{-}$中心氯原子价层电子对数$=\dfrac{1}{2}\times \left( 7+1-3\times 2 \right)+3=4$,采取$\rm s{{p}^{3}}$杂化,则$\rm VSEPR$模型为四面体形,$\rm D$错误;
$\text{N}{{\text{F}}_{3}}$是微电子工业中一种优良的等离子蚀刻气体,可用以下方法制备:$\text{4N}{{\text{H}}_{\text{3}}}\text{+3}{{\text{F}}_{\text{2}}}\text{=N}{{\text{F}}_{\text{3}}}\text{+3N}{{\text{H}}_{\text{4}}}\text{F}$。
①比较键角的大小:$\text{N}{{\text{H}}_{3}}$ $\text{N}{{\text{F}}_{3}}\rm ($填“$\rm \gt $”、“$\rm \lt $”或“$\rm =$”$\rm )$
②比较配位键的强弱:${{\text{H}}_{3}}\text{N}\to \text{B}{{\text{F}}_{3}}$ ${{\text{F}}_{3}}\text{N}\to \text{B}{{\text{F}}_{3}}\rm ($填“$\rm \gt $”、“$\rm \lt $”或“$\rm =$”$\rm )$
$\\rm \\gt $;$\\rm \\gt $
"]]①由于电负性$\rm F\gt N\gt H$,则$\rm N{{F}_{3}}$分子中成键电子对离$\rm N$原子更远,两个$\rm N-F$键之间的斥力减小,故$\rm N{{F}_{3}}$中的键角更小,键角更大的是$\rm \text{N}{{\text{H}}_{\text{3}}}$,则键角$\rm N{{H}_{3}}\gt N{{F}_{3}}$;
②由于电负性$\rm F\gt N\gt H$,则$\rm N{{F}_{3}}$中氮原子对孤电子对吸引力强于$\rm \text{N}{{\text{H}}_{\text{3}}}$,更难提供孤电子对与$\rm B{{F}_{3}}$中的$\rm B$形成配位键,则配位键得强弱:$\rm {{\text{H}}_{3}}\text{N}\to B{{F}_{3}}\gt {{\text{F}}_{3}}\text{N}\to B{{F}_{3}}$;
一般来说,晶体结构中阴、阳离子的配位数由结构中阴、阳离子半径的比值来决定。${{\text{K}}^{+}}$的半径与$\text{NH}_{4}^{+}$的半径非常接近。两种物质的晶胞结构如图所示:
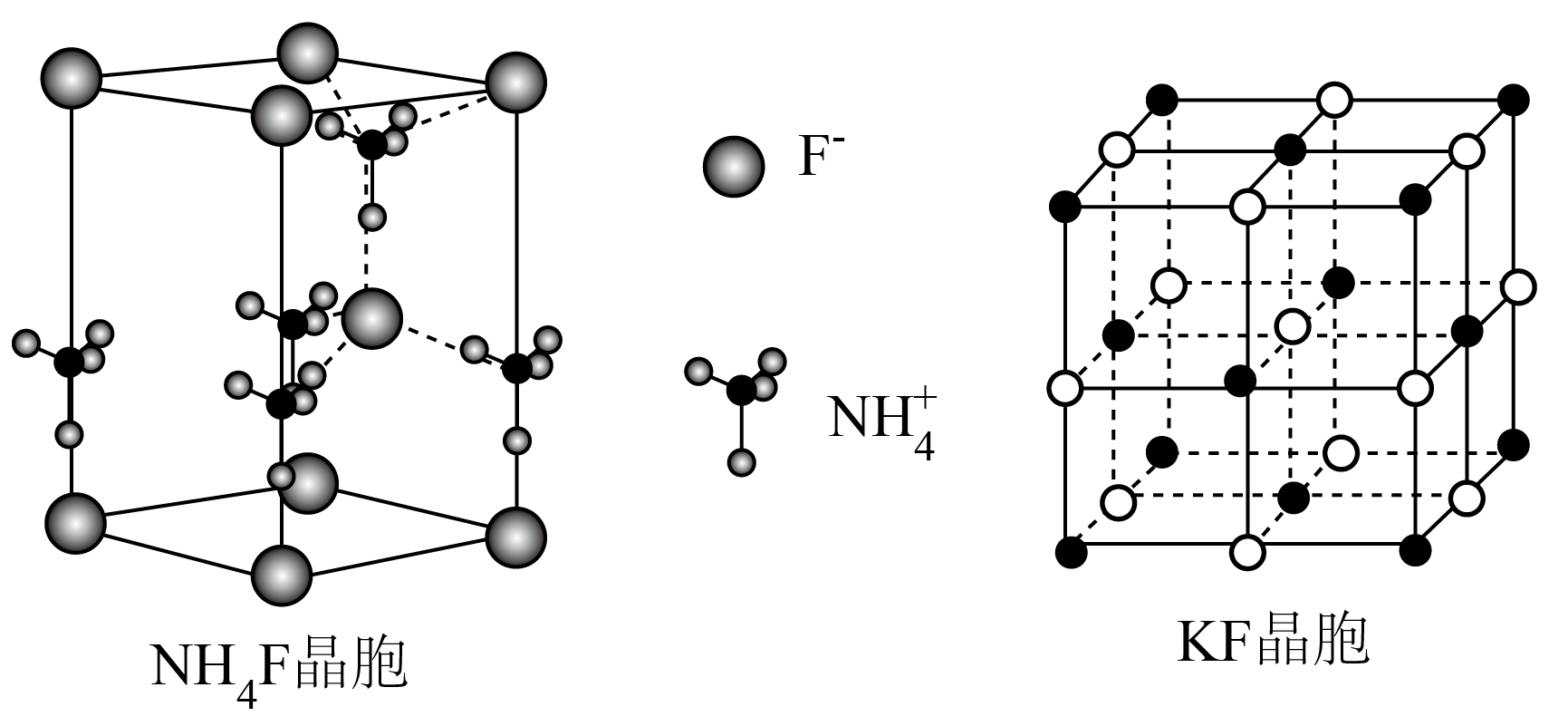
①$\text{N}{{\text{H}}_{4}}\text{F}$晶胞中,${{\text{F}}^{-}}$的配位数为 。
②$\text{N}{{\text{H}}_{4}}\text{F}$晶胞中的阴、阳配位数与$\rm KF$不同的原因是 。
$\\rm 4$;$\\rm \\text{N}{{\\text{H}}_{\\text{4}}}\\text{F}$晶胞中,每个$\\rm \\text{NH}_{4}^{+}$中有四个$\\rm H$原子与周围四个$\\rm {{\\text{F}}^{-}}$形成氢键,$\\rm N$、$\\rm H$、$\\rm F$原子在一条直线上,形成一个正四面体结构
"]]①由$\rm \text{N}{{\text{H}}_{4}}\text{F}$晶胞图可知,晶体中每个$\rm {{\text{F}}^{-}}$周围与其距离最近且相等的$\rm \text{NH}_{4}^{+}$的数量是$\rm 4$,则$\rm {{\text{F}}^{-}}$的配位数为$\rm 4$;
②$\rm KF$晶胞中只存在离子键,所以阴、阳配位数均为$\rm 6$,但在$\rm \text{N}{{\text{H}}_{4}}\text{F}$晶胞中,每个$\rm \text{NH}_{4}^{+}$中有四个$\rm H$原子与周围四个$\rm {{\text{F}}^{-}}$形成氢键,$\rm N$、$\rm H$、$\rm F$原子在一条直线上,形成一个正四面体结构,不能像$\rm KF$晶胞紧密堆积,因此$\rm \text{N}{{\text{H}}_{4}}\text{F}$晶胞中的阴、阳配位数与$\rm KF$不同;
湿法生产磷酸的废液中含有一种二元强酸${{\text{H}}_{2}}\text{Si}{{\text{F}}_{6}}$,利用废液可以生产白炭黑和冰晶石$\left( \text{N}{{\text{a}}_{3}}\text{Al}{{\text{F}}_{6}} \right)$。
过程如下:
步骤Ⅰ:向废液中加入$\text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{4}}$溶液,过滤、洗涤,得到$\text{N}{{\text{a}}_{2}}\text{Si}{{\text{F}}_{6}}$固体。
步骤Ⅱ:$\text{N}{{\text{a}}_{2}}\text{Si}{{\text{F}}_{6}}$经过下列流程,分别得到白炭黑和冰晶石。
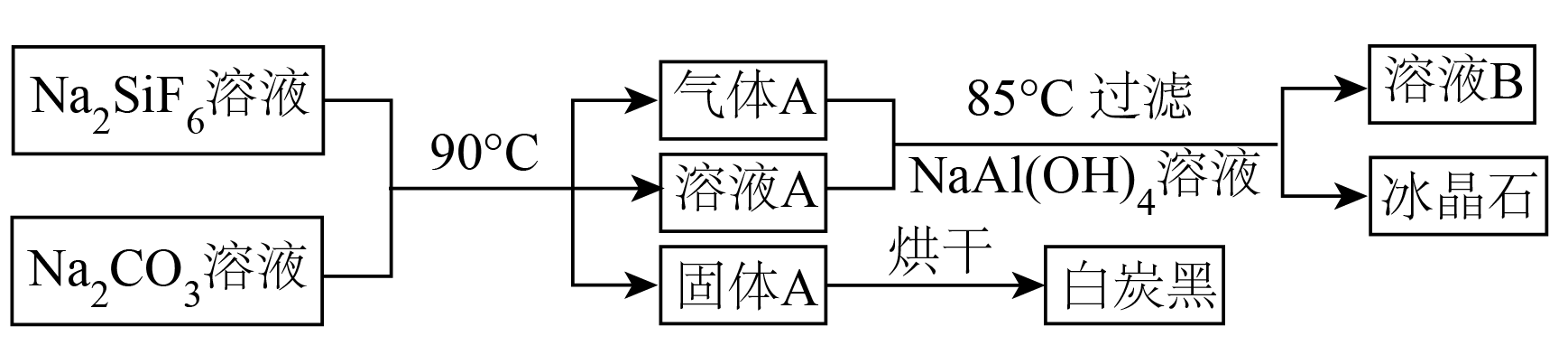
已知:$\text{N}{{\text{a}}_{2}}\text{Si}{{\text{F}}_{6}}$在水中溶解度随温度的升高急剧增大,$\text{N}{{\text{a}}_{2}}\text{Si}{{\text{F}}_{6}}$溶液在加热的过程中会与水发生反应,生成的产物中没有$\text{Si}-\text{F}$键。${{K}_{\text{a}}}\left( \text{HF} \right)=3.5\times {{10}^{-4}}$。
①写出步骤Ⅰ中的离子方程式: 。
②$\text{N}{{\text{a}}_{2}}\text{Si}{{\text{F}}_{6}}$溶液在长时间加热之后$\rm ($忽略物质的挥发$\rm )$,溶液的$\rm pH$ 。$\rm ($填“增大”、“减小”或“不变”$\rm )$
③白炭黑的主要成分是 。$\rm ($写化学式$\rm )$
④写出生产冰晶石的化学方程式: 。
$\\rm \\text{2N}{{\\text{a}}^{+}}\\text{+SiF}_{\\text{6}}^{\\text{2-}}\\text{=N}{{\\text{a}}_{\\text{2}}}\\text{Si}{{\\text{F}}_{\\text{6}}}\\downarrow $;减小;$\\rm \\text{Si}{{\\text{O}}_{\\text{2}}}$;$\\text{6NaF+2C}\\text{O}_{\\text{2}}\\text{+NaAl}\\left( \\text{OH}\\right)_{\\text{4}}\\text{=2N}\\text{a}_{\\text{2}}\\text{C}\\text{O}_{\\text{3}}\\text{+N}\\text{a}_{\\text{3}}\\text{Al}{\\text F_6}\\downarrow\\text{+2}\\text{H}_{\\text{2}}\\text{O}$
"]]$\rm \text{N}{{\text{a}}_{2}}\text{Si}{{\text{F}}_{6}}$溶液在加热的过程中会与水发生反应,生成的产物中没有$\rm \text{Si}-\text{F}$键,发生如下反应:$\rm N{{a}_{2}}Si{{F}_{6}}+2{{\text{H}}_{2}}\text{O}=Si{{O}_{2}}\downarrow +4HF+2NaF$,$\rm \text{N}{{\text{a}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}$与 $\rm HF$ 反应:$\rm N{{a}_{2}}C{{O}_{3}}+2HF=2NaF+{{\text{H}}_{2}}\text{O}+C{{O}_{2}}\uparrow $,则气体$\rm A$为$\rm \text{C}{{\text{O}}_{2}}$,溶液$\rm A$主要成分为$\rm NaF$,固体$\rm A$为$\rm \text{Si}{{\text{O}}_{\text{2}}}$或$ \text{Si}{{\text{O}}_{\text{2}}}\cdot {n}{{\text{H}}_{\text{2}}}\text{O}$,烘干后得到白炭黑$\rm \text{Si}{{\text{O}}_{2}}$;气体$\rm A\left( \text{C}{{\text{O}}_{2}} \right)$、溶液$\rm A\left( NaF \right)$与$\rm NaAl{{\left( OH \right)}_{4}}$溶液发生反应:$\rm \text{6NaF+2C}\text{O}_{\text{2}}\text{+NaAl}\left( \text{OH}\right)_{\text{4}}\text{=2N}\text{a}_{\text{2}}\text{C}\text{O}_{\text{3}}\text{+N}\text{a}_{\text{3}}\text{Al}{\text F_6}\downarrow\text{+2}\text{H}_{\text{2}}\text{O}$制备冰晶石,同时得到溶液$\rm B$($\rm \text{N}{{\text{a}}_{\text{2}}}\text{C}{{\text{O}}_{\text{3}}}$溶液);
①湿法生产磷酸的废液中含有一种二元强酸$\rm {{\text{H}}_{2}}\text{Si}{{\text{F}}_{6}}$,在水溶液中完全电离,向废液中加入$\rm \text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{4}}$溶液,过滤、洗涤,得到$\rm \text{N}{{\text{a}}_{2}}\text{Si}{{\text{F}}_{6}}$固体,则离子方程式为:$\rm \text{2N}{{\text{a}}^{+}}\text{+SiF}_{\text{6}}^{\text{2-}}\text{=N}{{\text{a}}_{\text{2}}}\text{Si}{{\text{F}}_{\text{6}}}\downarrow $;
②根据题目所给得已知信息:$\rm \text{N}{{\text{a}}_{2}}\text{Si}{{\text{F}}_{6}}$溶液在加热的过程中会与水发生反应,生成的产物中没有$\rm \text{Si}-\text{F}$键,说明$\rm SiF_{6}^{2-}$水解,产物中生成 $\rm HF$(弱酸),在长时间加热之后溶液的$\rm pH$减小;
③由分析可知,白炭黑的主要成分是$\rm \text{Si}{{\text{O}}_{2}}$;
④由分析可知,生产冰晶石的化学方程式为:$\rm \text{6NaF+2C}\text{O}_{\text{2}}\text{+NaAl}\left( \text{OH}\right)_{\text{4}}\text{=2N}\text{a}_{\text{2}}\text{C}\text{O}_{\text{3}}\text{+N}\text{a}_{\text{3}}\text{Al}{\text F_6}\downarrow\text{+2}\text{H}_{\text{2}}\text{O}$;
高中 | 配合物理论题目答案及解析(完整版)
