| 金属矿物的开发及利用 题目答案及解析
稿件来源:高途
| 金属矿物的开发及利用题目答案及解析如下,仅供参考!
必修二
第四章 化学与可持续发展
第一节 开发利用金属矿物和海水资源
金属矿物的开发及利用
铈$\rm (Ce)$是地球上镧系元素中含量最丰富的稀土金属,可用于制备玻璃添加剂,汽车尾气净化催化剂等。工业上利用某种含铈矿石$\rm ($主要成分为$\rm CeFC{{O}_{3}}$,还含少量$\rm BaO$、$\rm Si{{O}_{2}}$等$\rm )$制取金属铈的一种工艺流程如图。回答下列问题:
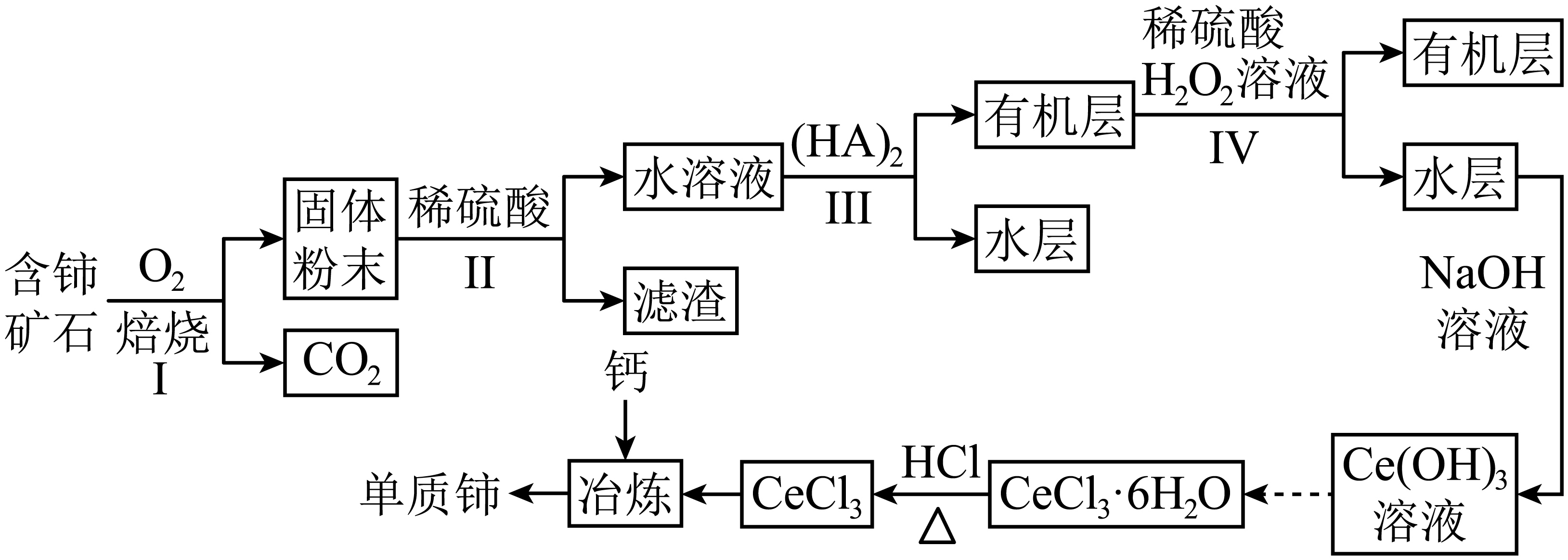
已知:①${{K}_{\rm sp}}\rm \left[ Ce{{(OH)}_{3}} \right]=1.0\times {{10}^{-20}}$。
②硫酸体系中,$\rm C{{e}^{4+}}$在$\rm {{(HA)}_{2}}$中的溶解度大于其在水中的溶解度,$\rm {Ce}^{3+}$与之相反。
焙烧时常采用逆流操作,即空气从焙烧炉下部通入,矿石从焙烧炉上部加入,这样操作的目的是 。
增大接触面积,提高反应速率
"]]焙烧时常采用逆流操作,即空气从焙烧炉下部通入,矿石从焙烧炉上部加入,这样操作的目的是:增大接触面积,提高反应速率。
滤渣的主要成分是$\rm Si{{O}_{2}}$和 $\rm ($填化学式$\rm )$,写出一条该物质在医疗上的应用: 。
$\\rm BaS{{O}_{4}}$;钡餐
"]]根据分析可知,滤渣的主要成分是$\rm Si{{O}_{2}}$和$\rm BaS{{O}_{4}}$,写出一条该物质在医疗上的应用:$\rm BaSO_{4}$可做钡餐。
步骤Ⅲ的操作名称是 。
分液
"]]步骤Ⅲ的操作将有机层与水层分离,名称是分液。
步骤$\rm IV$中发生反应的离子方程式为 ,该步骤通常控制温度为$\rm 40\sim50{\ }^\circ C$的原因是 。
$\\rm 2C{{e}^{4+}}+{{H}_{2}}{{O}_{2}}=2C{{e}^{3+}}+{{O}_{2}}\\uparrow +2{{H}^{+}}$;利于加快酸浸速率,防止双氧水分解
"]]步骤$\rm IV$加入$\rm H_{2}O_{2}$,将$\rm C{{e}^{4+}}$转化为$\rm {Ce}^{3+}$进入水层,发生反应的离子方程式为$\rm 2C{{e}^{4+}}+{{H}_{2}}{{O}_{2}}=2C{{e}^{3+}}+{{O}_{2}}\uparrow +2{{H}^{+}}$;过氧化氢受热易分解,反应时控制温度为$\rm 40\sim50\ {}^\circ C$之间既有利于加快酸浸速率,又防止温度过高导致双氧水分解。
步骤$\rm IV$后,向水层中加入$\rm NaOH$溶液来调节溶液的$\rm pH$,$\rm pH$大于 时,$\rm {Ce}^{3+}$完全生成$\rm {Ce}({OH})_{3}$沉淀。已知当溶液中某离子浓度小于$\rm 1.0\times 10^{-5} {\ mol} \cdot {L}^{-1}$时,可认为该离子沉淀完全。
$\\rm 9$
"]]溶液中的$c{\rm (Ce^{3+})}$等于$\rm 1\times 10^{-5}\ mol\cdot L^{-1}$,可认为$\rm Ce^{3+}$沉淀完全,由氢氧化铈的溶度积可知,${{K}_{\rm sp}}{\rm \left[ Ce(OH{{)}_{3}} \right]}=c{\rm (C{{e}^{3+}})}{{c}^{3}}{\rm (O{{H}^{-}})}\Rightarrow c{\rm (O{{H}^{-}})}=\sqrt[3]{\dfrac{{{K}_{\rm sp}}\rm \left[ Ce(OH{{)}_{3}} \right]}{c{\rm (C{{e}^{3+}})}}}=\rm \sqrt[3]{\dfrac{1\times {{10}^{-20}}}{1\times {{10}^{-5}}\ mol/L}}=1\times {{10}^{-5}}\ mol/L$,$c{\rm ({{H}^{+}})}=1\times {{10}^{-9}}\rm \ mol/L$,$\rm pH$大于$\rm 9$时,$\rm {Ce}^{3+}$完全生成$\rm {Ce}({OH})_{3}$沉淀。
加热$\rm CeC{{l}_{3}}\cdot 6{{H}_{2}}O$制备无水$\rm CeC{{l}_{3}}$时,$\rm HCl$的作用是 。下列金属冶炼方法与本工艺流程中加入钙冶炼$\rm Ce$的方法相似的是 $\rm ($填字母$\rm )$。
$\rm A$.高炉炼铁
$\rm B$.电解熔融$\rm NaCl$制钠
$\rm C$.利用铝热反应制锰
$\rm D$.氧化汞分解制汞
抑制$\\rm CeC{{l}_{3}}$水解;$\\rm AC$
"]]$\rm CeC{{l}_{3}}$是强酸弱碱盐,加热$\rm CeC{{l}_{3}}\cdot 6{{H}_{2}}O$制备无水$\rm CeC{{l}_{3}}$时,$\rm HCl$的作用是:抑制$\rm CeC{{l}_{3}}$水解;本工艺流程中加入钙冶炼$\rm Ce$的方法为热还原法,$\rm A$.高炉炼铁为热还原法,$\rm A$正确; $\rm B$.电解熔融$\rm NaCl$制钠是电解法,$\rm B$错误; $\rm C$.利用铝热反应制锰为热还原法,$\rm C$正确; $\rm D$.氧化汞分解制汞是热分解法,$\rm D$错误。
| 金属矿物的开发及利用题目答案及解析(完整版)
