| 铁盐 亚铁盐 题目答案及解析
稿件来源:高途
| 铁盐 亚铁盐题目答案及解析如下,仅供参考!
必修一
第三章 金属及其化合物
第二节 几种重要的金属化合物
铁盐 亚铁盐
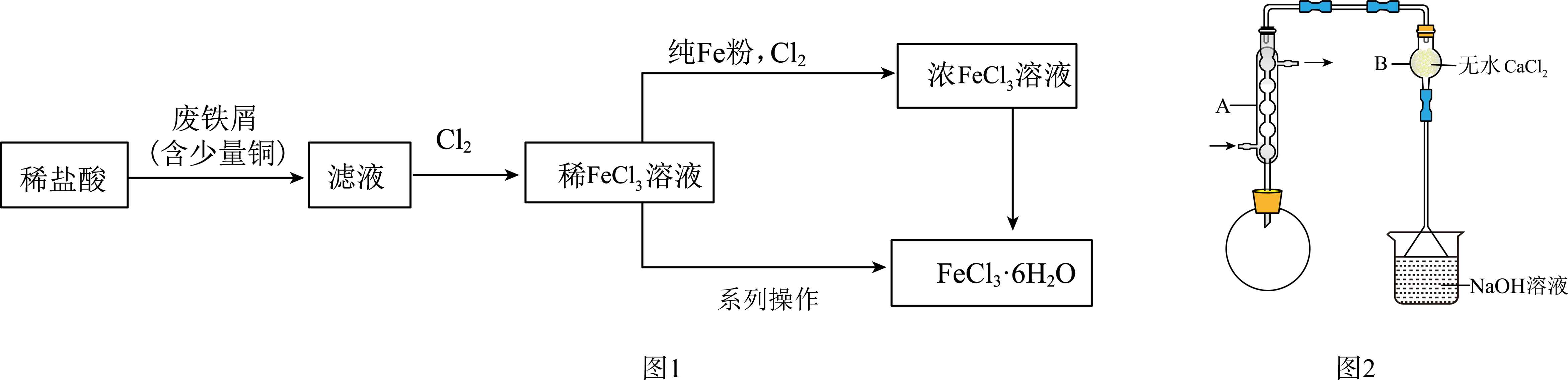
氯化铁是重要的化工原料,其实验室制备方法为:
Ⅰ.制备$\text{FeC}{{\text{l}}_{\text{3}}}\cdot \text{6}{{\text{H}}_{\text{2}}}\text{O}$:流程如图$\rm 1$。
Ⅱ.由$\text{FeC}{{\text{l}}_{\text{3}}}\cdot \text{6}{{\text{H}}_{\text{2}}}\text{O}$制备无水$\text{FeC}{{\text{l}}_{\text{3}}}$:将$\text{FeC}{{\text{l}}_{\text{3}}}\cdot \text{6}{{\text{H}}_{\text{2}}}\text{O}$与液体$\text{SOC}{{\text{l}}_{\text{2}}}$混合并加热,制得无水$\text{FeC}{{\text{l}}_{\text{3}}}$,装置如图$\rm 2($夹持和加热装置略$\rm )$。
已知:①$\text{SOC}{{\text{l}}_{\text{2}}}$沸点为$\rm 77$ $\rm ^\circ\rm C$;②反应方程式为:$\text{FeC}{{\text{l}}_{\text{3}}}\cdot \text{6}{{\text{H}}_{2}}\text{O}+6\text{SOC}{{\text{l}}_{\text{2}}}\begin{matrix} \underline{\underline{{\triangle }}} \\ {} \\ \end{matrix}\text{FeC}{{\text{l}}_{\text{3}}}+6\text{S}{{\text{O}}_{\text{2}}}\uparrow +\text{12HCl}\uparrow $
请回答:
图$\rm 2$中仪器$\rm B$的名称是 。
$\\rm ($球形$\\rm )$干燥管
"]]根据结构可知,图$\rm 2$中仪器$\rm B$的名称是$\rm ($球形$\rm )$干燥管。
下列说法不正确的是 。
$\rm A$.检验稀$\rm \text{FeC}{{\text{l}}_{\text{3}}}$溶液中是否残留$\rm \text{F}{{\text{e}}^{\text{2+}}}$,可滴加少量酸性高锰酸钾
$\rm B$.图$\rm 2$中的加热宜采用水浴的方式
$\rm C$.图$\rm 2$中的无水$\rm \text{CaC}{{\text{l}}_{\text{2}}}$可替换为碱石灰
$\rm D$.可采用同样方式由$\text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{\text{4}}}\cdot \text{10}{{\text{H}}_{2}}\text{O}$制备$\text{N}{{\text{a}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}$
$\\rm ACD$
"]]$\rm A$. 亚铁离子、氯离子在酸性条件下均能还原高锰酸钾溶液出现褪色现象,则不能通过滴加少量酸性高锰酸钾检验稀$\rm \text{FeC}{{\text{l}}_{\text{3}}}$溶液中是否残留$\rm \text{F}{{\text{e}}^{\text{2+}}}$,$\rm A$错误;
$\rm B$. 已知$\rm \text{SOC}{{\text{l}}_{\text{2}}}$沸点为$\rm 77$ $\rm ^\circ\rm C$,图$\rm 2$中的加热宜采用水浴的方式,以控制加热温度防止$\rm \text{SOC}{{\text{l}}_{\text{2}}}$挥发,$\rm B$正确;
$\rm C$. 无水$\rm CaCl_{2}$主要作用是干燥,防止氢氧化钠溶液中水蒸气进入到发生装置中,而碱石灰会与二氧化硫、$\rm HCl$反应,从而失去干燥作用,则图$\rm 2$中的无水$\rm \text{CaC}{{\text{l}}_{\text{2}}}$不可替换为碱石灰,$\rm C$错误;
$\rm D$.氯化铁溶液易水解,不采取措施直接加热$\text{FeC}{{\text{l}}_{\text{3}}}\cdot \text{6}{{\text{H}}_{\text{2}}}\text{O}$通常不能得到$\text{FeC}{{\text{l}}_{\text{3}}}$、得到氢氧化铁等,通过$\text{FeC}{{\text{l}}_{\text{3}}}\cdot \text{6}{{\text{H}}_{2}}\text{O}+6\text{SOC}{{\text{l}}_{\text{2}}}\begin{matrix} \underline{\underline{{\triangle }}} \\ {} \\ \end{matrix}\text{FeC}{{\text{l}}_{\text{3}}}+6\text{S}{{\text{O}}_{\text{2}}}\uparrow +\text{12HCl}\uparrow $则可得到无水$\text{FeC}{{\text{l}}_{\text{3}}}$,而硫酸钠是不挥发性强酸的钠盐,不会水解,在控制一定温度下加热可由$\text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{\text{4}}}\cdot \text{10}{{\text{H}}_{2}}\text{O}$制备$\text{N}{{\text{a}}_{\text{2}}}\text{S}{{\text{O}}_{\text{4}}}$,$\rm D$错误;
选$\rm ACD$。
请对图$\rm 1$中“系列操作”排序: 。
$\rm →$ $\rm →$ $\rm →$ $\rm →$ $\rm ($填字母$\rm )$。
$\rm a$.冷却至室温 $\rm b$.用饱和$\rm \text{NaCl}$溶液洗涤 $\rm c$.用浓$\rm HCl$洗涤 $\rm d$.蒸发至出现晶膜
$\rm e$.蒸发至出现大量固体 $\rm f$.常温干燥 $\rm g$.低温干燥 $\rm h$.过滤 $\rm i$.趁热过滤
$\\rm dahcg$
"]]图$\rm 1$中氯化铁稀溶液经“系列操作”得到$\text{FeC}{{\text{l}}_{\text{3}}}\cdot \text{6}{{\text{H}}_{\text{2}}}\text{O}$,氯化铁是挥发性强酸的弱碱盐,应采用冷却结晶法获得晶体、经过滤后洗涤干燥,由于氯化铁易水解,采用浓盐酸洗涤,氢离子浓度大可抑制其水解又不会引入杂质,还可以减少产品损失,而低温干燥可以防止晶体失去结晶水;故对图$\rm 1$中“系列操作”排序:$\rm d$.先蒸发浓缩,蒸发至出现晶膜,此时溶液达到饱和状态;$\rm a$.冷却至室温析出$\rm \text{FeC}{{\text{l}}_{\text{3}}}\cdot \text{6}{{\text{H}}_{\text{2}}}\text{O}$晶体;$\rm h$.过滤分离出晶体;$\rm c$.用浓$\rm HCl$洗涤,洗去晶体表面的杂质;$\rm g$.低温干燥;
故选:$\rm dahcg$;
制得的无水$\text{FeC}{{\text{l}}_{\text{3}}}$含有少量还原性杂质,试分析原因 。
$\\text{FeC}{{\\text{l}}_{\\text{3}}}\\cdot \\text{6}{{\\text{H}}_{2}}\\text{O}+6\\text{SOC}{{\\text{l}}_{\\text{2}}}\\begin{matrix} \\underline{\\underline{{\\triangle }}} \\\\ {} \\\\ \\end{matrix}\\text{FeC}{{\\text{l}}_{\\text{3}}}+6\\text{S}{{\\text{O}}_{\\text{2}}}\\uparrow +\\text{12HCl}\\uparrow $产物中$\\text{S}{{\\text{O}}_{\\text{2}}}$具有强还原性,可将$\\text{F}{{\\text{e}}^{\\text{3+}}}$还原为$\\text{F}{{\\text{e}}^{\\text{2+}}}$
"]]制得的无水$\text{FeC}{{\text{l}}_{\text{3}}}$含有少量还原性杂质,试分析原因为:根据信息②反应方程式为:$\text{FeC}{{\text{l}}_{\text{3}}}\cdot \text{6}{{\text{H}}_{2}}\text{O}+6\text{SOC}{{\text{l}}_{\text{2}}}\begin{matrix} \underline{\underline{{\triangle }}} \\ {} \\ \end{matrix}\text{FeC}{{\text{l}}_{\text{3}}}+6\text{S}{{\text{O}}_{\text{2}}}\uparrow +\text{12HCl}\uparrow $,产物中$\text{S}{{\text{O}}_{\text{2}}}$具有强还原性,可将$\text{F}{{\text{e}}^{\text{3+}}}$还原为$\text{F}{{\text{e}}^{\text{2+}}}$。
用莫尔法测定无水$\text{FeC}{{\text{l}}_{\text{3}}}$的纯度:准确称取$\rm 0.4000$ $\rm g$样品配成$\rm 100$ $\rm mL$溶液,移取$\rm 25.00$ $\rm mL$于锥形瓶中,加入三乙醇胺屏蔽铁离子形成稳定配合物,调节$\text{pH}=8.5\sim10.5$,滴加指示剂${{\text{K}}_{\text{2}}}\text{Cr}{{\text{O}}_{\text{4}}}$溶液。不断摇动下,用$\text{0}\text{.1000 mol}\cdot {{\text{L}}^{-1}}\text{ AgN}{{\text{O}}_{\text{3}}}$标准溶液滴定至浅红色$\rm ($有$\text{A}{{\text{g}}_{\text{2}}}\text{Cr}{{\text{O}}_{\text{4}}}$沉淀$\rm )$,$\rm 30$秒内不褪色。
平行测试$\rm 3$次,平均消耗$\text{AgN}{{\text{O}}_{\text{3}}}$标准溶液$\rm 15.00$ $\rm mL$。
①无水$\text{FeC}{{\text{l}}_{\text{3}}}$的纯度为 。
②测定过程中溶液$\text{pH}$过低或过高均会影响测定结果,原因是 。
$\\rm 81.25\\%$ ; $\\text{pH}$过低,部分$\\text{CrO}_{\\text{4}}^{2-}$转化为$\\text{C}{{\\text{r}}_{2}}\\text{O}_{7}^{2-}$:$\\text{pH}$过高,可能生成$\\text{AgOH}$,均会使消耗的$\\text{AgN}{{\\text{O}}_{\\text{3}}}$偏多
"]]①$\rm FeCl_{3}+3AgNO_{3}=3AgCl↓+Fe(NO_{3})_{3}$,根据方程式可知$n\left( \text{FeC}{{\text{l}}_{\text{3}}} \right)=\dfrac{1}{3}n\left( \text{AgN}{{\text{O}}_{\text{3}}} \right)=\dfrac{1}{3}\times 0.1000\text{ mol/L}\times 0.01500\text{ L}=5\times {{10}^{-4}}\text{ mol}$,产品无水$\text{FeC}{{\text{l}}_{\text{3}}}$的纯度为$\dfrac{5\times {{10}^{-4}}\text{ mol}\times 162.5\text{ g/mol}\times \dfrac{100\text{ mL}}{25.00\text{ mL}}}{0.4000\text{ g}}\times 100\%=81.25\%$。
②测定过程中溶液$\text{pH}$过低或过高均会影响测定结果,原因是:$\text{pH}$过低,发生$\rm 2\text{CrO}_{4}^{2-}\rm +2H^{+}\rightleftharpoons\text{C}{{\text{r}}_{2}}\text{O}_{7}^{2-}+{{\text{H}}_{\text{2}}}\text{O}$,部分$\text{CrO}_{\text{4}}^{2-}$转化为$\text{C}{{\text{r}}_{2}}\text{O}_{7}^{2-}$,$\text{pH}$过高,可能生成$\text{AgOH}$,均会使消耗的$\text{AgN}{{\text{O}}_{\text{3}}}$偏多。
| 铁盐 亚铁盐题目答案及解析(完整版)
