| 原子的基态与激发态、光谱 题目答案及解析
稿件来源:高途
| 原子的基态与激发态、光谱题目答案及解析如下,仅供参考!
选修三
第一章 原子结构与性质
第一节 原子结构
原子的基态与激发态、光谱
第$\rm VIA$族元素及其化合物有许多用途。请回答:
关于第$\rm VIA$族元素的描述,下列说法不正确的是 。
$\rm A$.基态$\rm S$原子的价层电子轨道表示式为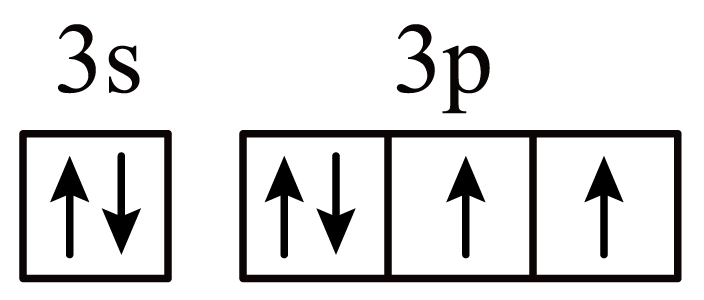
$\rm B$.基态$\rm {O}$原子核外电子运动状态有$\rm 8$种
$\rm C$.电子排布式为$\rm \left[ Ne \right]3{{s}^{1}}3{{p}^{5}}$的$\rm S$原子,用光谱仪可捕捉到发射光谱
$\rm D$.第一电离能:$\rm Se\gt S$
$\\rm D$
"]]$\rm A$.基态$\rm S$原子的价层电子排布式为$\rm 3s^{2}3p^{4}$,价层电子轨道表示式为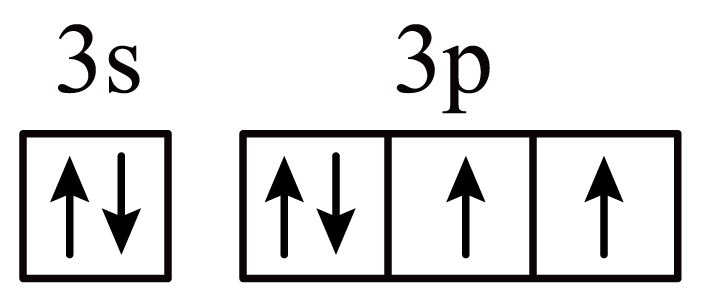 ,$\rm A$正确;
,$\rm A$正确;
$\rm B$.基态$\rm {O}$原子核外有$\rm 8$个电子,$\rm 8$个电子的运动状态各不相同,则电子的运动状态有$\rm 8$种,$\rm B$正确;
$\rm C$.电子排布式为$\rm \left[ Ne \right]3{{s}^{1}}3{{p}^{5}}$,说明$\rm S$原子核外有一个电子从$\rm 3s$能级跃迁到了$\rm 3p$能级上,$\rm S$处于激发态,不稳定,电子从激发态回到基态会释放能量,用光谱仪可捕捉到发射光谱,$\rm C$正确;
$\rm D$.同主族元素的第一电离能从上到下依次减小,则第一电离能:$\rm Se\lt S$,$\rm D$错误;
某化合物晶体的晶胞如图,该化合物的化学式为 。
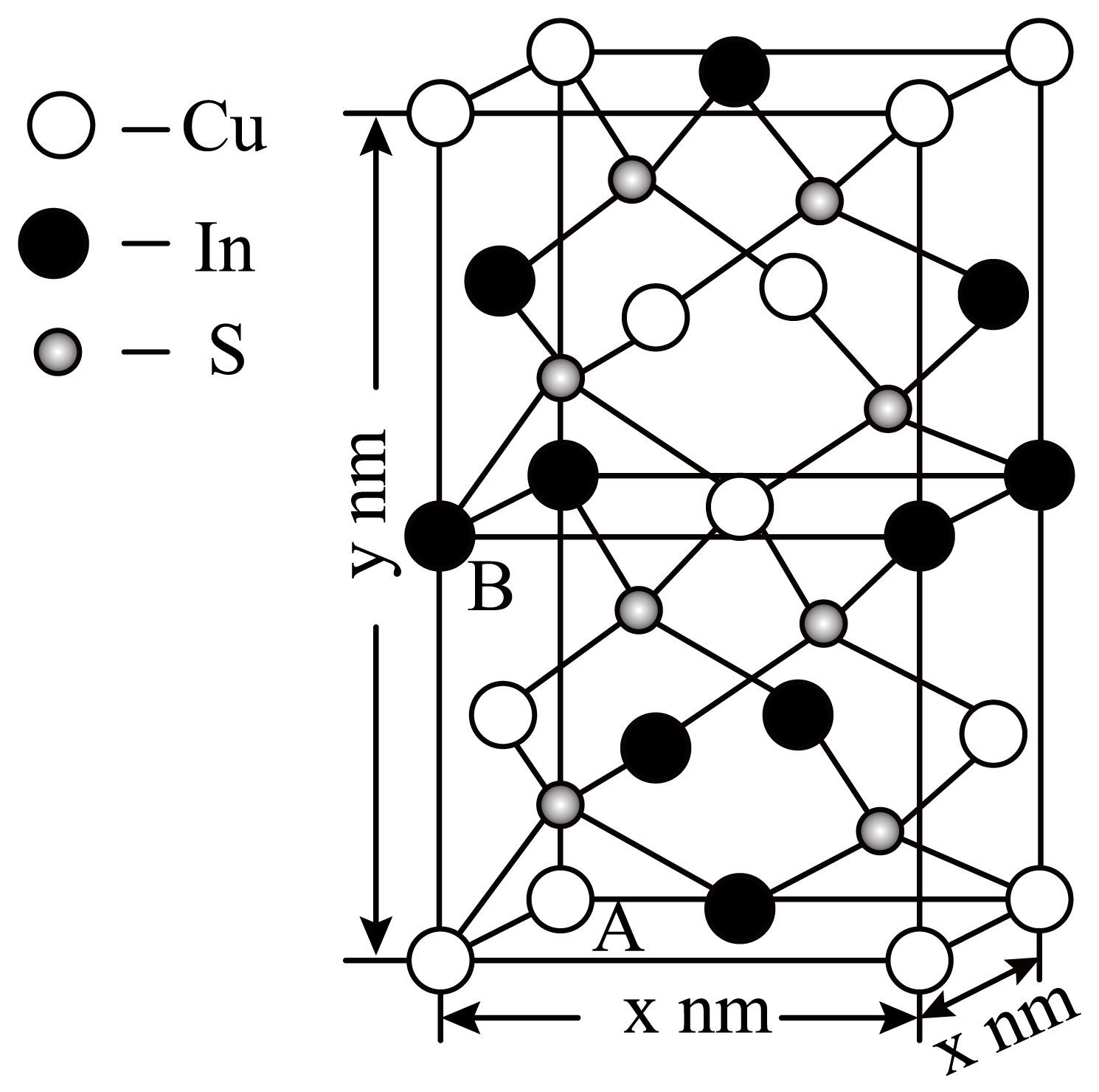
$\\rm CuIn{{S}_{2}}$
"]]晶胞中$\rm Cu$位于$\rm 8$个顶点和$\rm 4$个面上及一个体内,$\rm In$位于$\rm 6$个面上和$\rm 4$条棱上,$\rm S$位于体内,则一个晶胞中含$\rm Cu$:$\rm 8\times \dfrac{1}{8}+4\times \dfrac{1}{2}+1=4$个,含$\rm In$:$\rm 6\times \dfrac{1}{2}+4\times \dfrac{1}{4}=4$个,含$\rm S8$个,则该化合物的化学式为$\rm CuIn{{S}_{2}}$。
$\rm S$的某种同素异形体由$\rm {{S}_{8}}$环$\rm ($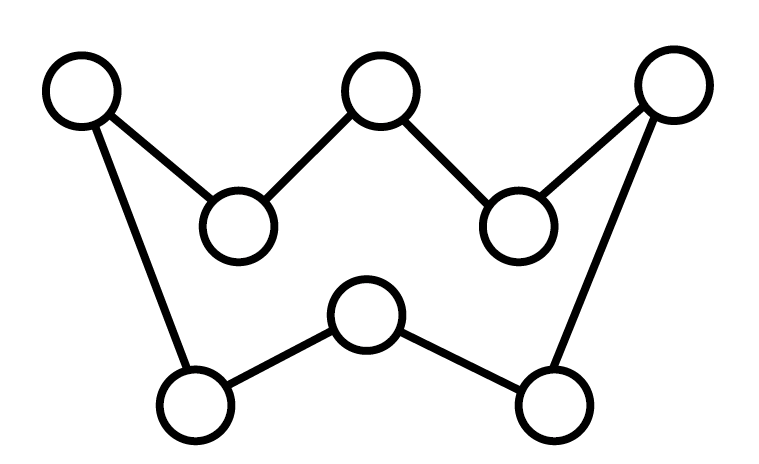 $\rm )$构成,$\rm {{S}_{8}}$环中$\rm \angle S-S-S$平均键角最接近 $\rm ($填字母$\rm )$。
$\rm )$构成,$\rm {{S}_{8}}$环中$\rm \angle S-S-S$平均键角最接近 $\rm ($填字母$\rm )$。
$\rm A$.$\rm {{105}{^\circ }}$
$\rm B$.$\rm {{112}{^\circ }}$
$\rm C$.$\rm {{120}{^\circ }}$
$\rm D$.$\rm {{180}{^\circ }}$
$\\rm A$
"]]$\rm {{S}_{8}}$环中的$\rm S$的$\rm \sigma $键电子对数为$\rm 2$,孤电子对数为$\rm 2$,$\rm S$采取$\rm sp^{3}$杂化,则$\rm \angle S-S-S$平均键角要小于$\rm {{109}^{\circ }}28^{\prime}$,最接近$\rm {{105}^{\circ }}$,选$\rm A$。
$\rm O{{F}_{2}}$与$\rm {{H}_{2}}O$的空间结构相似,同为$\rm V$形,但$\rm {{H}_{2}}O$的极性很强,而$\rm O{{F}_{2}}$的极性很小,请从原子的电负性、中心原子上的孤电子对等角度说明理由: 。
氧和氢的电负性差大于氟与氧的电负性差;$\\rm O{{F}_{2}}$中氧原子有两个孤电子对,抵消了$\\rm F-O$中共用电子对偏向$\\rm F$而产生的极性
"]]从原子的电负性来看,成键原子的电负性差越大,键的极性越大,氧和氢的电负性差大于氟与氧的电负性差,则可能出现$\rm {{H}_{2}}O$的极性很强而$\rm O{{F}_{2}}$的极性很小的情况;从中心原子上的孤电子对的角度来看,$\rm O{{F}_{2}}$中氧原子有两个孤电子对,抵消了$\rm F-O$中共用电子对偏向$\rm F$而产生的极性,而使$\rm O{{F}_{2}}$的极性很小。
用黄铜矿$\rm ($主要成分为$\rm CuFe{{S}_{2}})$制取三氧化二铁的工艺流程如图所示:
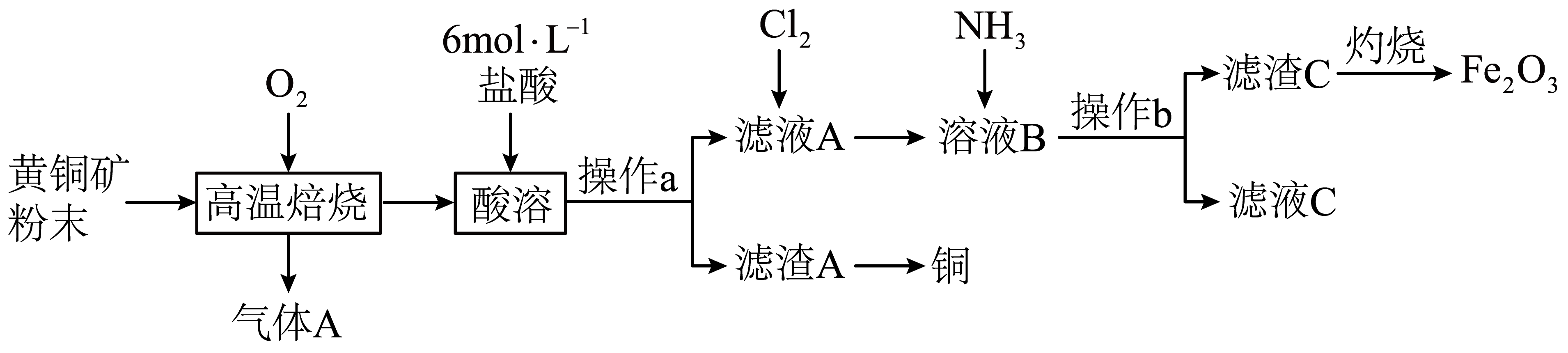
①操作$\rm b$是 。
②滤液$\rm C$中溶质的主要成分为 $\rm ($填化学式$\rm )$。
③气体$\rm A$的主要成分$\rm X$是一种大气污染物,高温焙烧时若金属元素均转化为高价态氧化物,黄铜矿粉末高温焙烧的反应方程式为 ,设计实验方案检验气体$\rm X$ 。
过滤; $\\rm N{{H}_{4}}Cl$;$\\rm 4CuFe{{S}_{2}}+13{{O}_{2}}\\begin{matrix} \\underline{\\underline{高温}} \\\\ {} \\\\ \\end{matrix}4CuO+2F{{e}_{2}}{{O}_{3}}+8S{{O}_{2}}$ ;将气体通入品红溶液,溶液褪色,加热煮沸溶液,恢复红色
"]]流程图中,黄铜矿$\rm ($主要成分为$\rm CuFe{{S}_{2}})$经高温焙烧可得到金属氧化物和$\rm S{{O}_{2}}$气体,金属氧化物经酸溶后转化为金属阳离子,往过滤所得的滤液中先通氯气再通氨气可以将铁元素转化为$\rm Fe(OH{{)}_{3}}$,再次过滤可得到$\rm Fe(OH{{)}_{3}}$,$\rm Fe(OH{{)}_{3}}$经灼烧得到三氧化二铁。
①操作$\rm b$实现了固液分离,$\rm b$是过滤。
②滤液$\rm A$中含有$\rm FeC{{l}_{3}}$等,通入氯气是为了将可能存在的亚铁离子氧化为正三价铁离子,加入氨气后,$\rm FeC{{l}_{3}}$与$\rm N{{H}_{3}}\cdot {{H}_{2}}O$反应生成$\rm Fe(OH{{)}_{3}}$和$\rm N{{H}_{4}}Cl$,故滤液$\rm C$中溶质的主要成分为$\rm N{{H}_{4}}Cl$。
③黄铜矿$\rm ($主要成分为$\rm CuFe{{S}_{2}})$高温焙烧时产生的气体$\rm A$为$\rm SO_{2}$,$\rm SO_{2}$是一种大气污染物,同时金属元素均转化为高价态氧化物,即产物还有$\rm CuO$、$\rm F{{e}_{2}}{{O}_{3}}$,根据电子得失守恒和原子守恒,高温焙烧的反应方程式为$\rm 4CuFe{{S}_{2}}+13{{O}_{2}}\begin{matrix} \underline{\underline{高温}} \\ {} \\ \end{matrix}4CuO+2F{{e}_{2}}{{O}_{3}}+8S{{O}_{2}}$;检验$\rm SO_{2}$气体的方法是:将气体通入品红溶液,溶液褪色,加热煮沸溶液,恢复红色,说明该气体为二氧化硫。
| 原子的基态与激发态、光谱题目答案及解析(完整版)
