| 杂化轨道理论 题目答案及解析
稿件来源:高途
| 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
结构决定性质,性质决定用途。下列事实与结构因素匹配错误的是$\rm (\qquad)$
| 选项 | 事实 | 结构因素 |
| $\rm A$ | 原子光谱是不连续的线状谱线 | 原子的能级是量子化的 |
| $\rm B$ | $\rm 1000\ ^\circ \text{C}$以上时$\rm CuO$分解生成$\rm C{{u}_{2}}O$和$\rm {{O}_{2}}$ | $\rm +1$价铜的价层电子达到全充满结构 |
| $\rm C$ | $\rm C-Cl$键长:$\rm C{{H}_{3}}C{{H}_{2}}Cl\gt C{{H}_{2}}=CHCl\gt CH\equiv CCl$ | $\rm C$原子杂化方式及$\rm Cl$原子参与形成大$\rm \pi$键的数目 |
| $\rm D$ | 相同温度下,${{K}_{\rm a1}}($ | 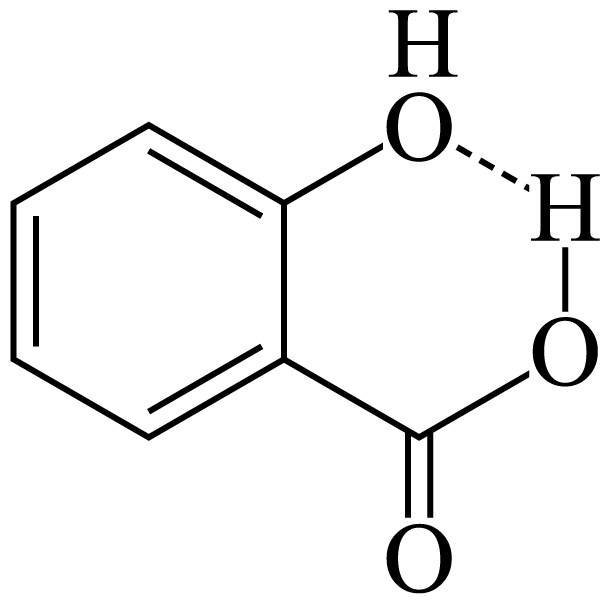 |
["
$\\rm A$
","$\\rm B$
","$\\rm C$
","$\\rm D$
"][["D"]]
$\rm A$.原子能级的量子化导致原子光谱是不连续的线状谱线,$\rm A$正确。
$\rm B$.$\rm 1000\ ^\circ \text{C}$以上时$\rm CuO$分解生成$\rm C{{u}_{2}}O$和$\rm {{O}_{2}}$,说明$\rm C{{u}_{2}}O$在高温时非常稳定,其原因是$\rm +1$价铜的价层电子排布为$\rm 3 d^{10}$全充满稳定结构,$\rm B$正确。
$\rm C$.氯乙烷、氯乙烯、氯乙炔三种分子中形成$\rm C-Cl$键的原子相同,键长取决于碳原子杂化轨道中$\rm \operatorname{s}$成分的多少,$\rm \operatorname{s}$的成分越多,碳氯键越强,键长越短,同时也取决于氯原子参与形成大$\rm \pi$键的数目,形成的大$\rm \pi$键越多,碳氯键越短,键越强,$\rm C$正确。
$\rm D$.邻羟基苯甲酸形成分子内氢键如图: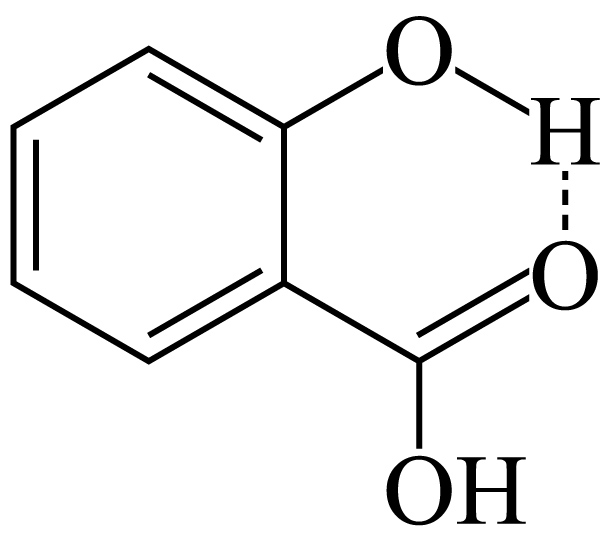 ,$\rm D$错误。
,$\rm D$错误。
故选:$\rm D$
| 杂化轨道理论题目答案及解析(完整版)
去刷题
相关题库:
在我国青海、西藏等地有许多干涸盐湖盛产含钠盐的。是一种易溶于水的白色固体,其水溶液用硫酸酸化可得到其分子结构可描述为。纯净的为无色小片状透明晶体。将与甲醇、浓硫酸混合点燃,可以产生独特的绿色火焰。已知此反应的原理为:在浓硫酸的催化下与甲醇反应生成硼酸三甲酯;发生燃烧,生成的水和逸出体系,而生成的留在反应体系中。结合上述材料和所学知识,判断下列说法正确的是
在一定条件下,化合物可转变为己内酰胺,该反应的主要途径如下:
结构决定物质的性质,下列实例与解释关系说法的是
卤代烃以三甲基溴丁烷水解为例在碱性条件下的水解机理如下已知水解过程中形成的碳正离子越稳定,反应越容易:下列说法正确的是
匹莫范色林是一种治疗帕金森病的药物,在耐受性和安全性方面都表现良好,因而有很大的市场前景。匹莫范色林的一种合成路线如下:
铁元素是生命活动中不可或缺的元素。
今日推荐 ![]()
![]()
![]()
