| 原子的基态与激发态、光谱 题目答案及解析
稿件来源:高途
| 原子的基态与激发态、光谱题目答案及解析如下,仅供参考!
选修三
第一章 原子结构与性质
第一节 原子结构
原子的基态与激发态、光谱
碱土元素及其化合物是构成化学和自然的基础。请回答:
下列有关第Ⅱ$\rm A$族元素的描述,正确的是 。
$\rm A$.基态$\rm Be$原子的核外电子云有$\rm 2$个伸展方向
$\rm B$.热稳定性:$\rm \text{BaO}\lt \text{Ba}{{\text{O}}_{2}}$
$\rm C$.在${{I}_{1}}\left( \text{Mg} \right)$、${{I}_{1}}\left( \text{Al} \right)$间出现“反常”的主要原因是$\rm Al$的最外层电子填充在能量较高的$\rm p$轨道上,易失去
$\rm D$.用铁丝蘸取钙盐溶液,经酒精灯外焰上灼烧,会产生原子光谱
$\\rm CD$
"]]$\rm A$.基态$\rm Be$原子的核外价电子排布式为$\rm 2s^{2}2p^{2}$,$\rm 2p$电子云有$\rm 4$种不同伸展方向,$\rm A$错误;
$\rm B$.两者阴阳离子所带电荷数相同,离子半径越小,越稳定,热稳定性:$\rm \text{BaO}\gt \text{Ba}{{\text{O}}_{2}}$,$\rm B$错误;
$\rm C$.$\rm Mg$最外层电子填充要$\rm 3s$轨道且全满状态,$\rm Al$的最外层电子填充在能量较高的$\rm 3p$轨道上,易失去,$\rm C$正确;
$\rm D$.用铁丝蘸取钙盐溶液,经酒精灯外焰上灼烧,会产生电子跃迁,发生原子光谱,$\rm D$正确;
故选:$\rm CD$;
$\text{CaC}{{\text{O}}_{3}}$有球霰石、方解石等多种形态,而自然界中主要存在的是方解石。制备过程中添加表面活性剂$\rm ($主要成分为十二烷基二甲基苄基氯化铵,其中一端带有正电荷$\rm )$可增加产物中球霰石的含量。
①表面活性剂可与球霰石形成两种吸附作用,分别为离子对吸附$\rm ($图$\rm 1-A)$和离子交换吸附$\rm ($图$\rm 1-B)$。请结合所学知识,描述“离子交换吸附”这一吸附过程 。

②表面活性剂能增加产物中球霰石的含量,可推测球霰石转化为方解石经历了 、再沉淀为方解石的过程。
③比较稳定性:球霰石 方解石$\rm ($填“大于”、“小于”$\rm )$
球霰石表面的$\\text{C}{{\\text{a}}^{2+}}$带正电,表面活性剂中带正电的一端可取代球霰石表面的$\\text{C}{{\\text{a}}^{2+}}$,并吸附于球霰石表面 ; 溶解 ; 小于
"]]①球霰石表面的$\text{C}{{\text{a}}^{2+}}$带正电,表面活性剂中带正电的一端受带负电离子吸引,并取代球霰石表面的$\text{C}{{\text{a}}^{2+}}$,并吸附于球霰石表面;
②增加产物中球霰石的含量,方解石经历了溶解,再沉淀为方解石的过程
③自然界中主要存在的是方解石说明方解石更稳定,故稳定性:球霰石小于方解石;
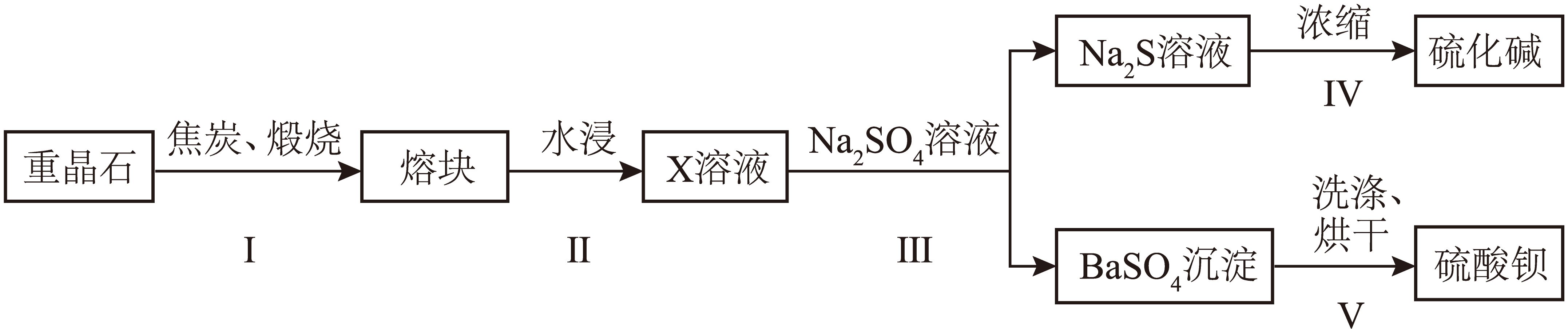
化工兴趣小组利用重晶石来生产$\text{BaS}{{\text{O}}_{4}}$和“硫化碱$\rm (\text{N}{{\text{a}}_{2}}\text{S}\rm )$”,设计了如下流程:
已知:$\rm 25$ $\rm ^\circ\rm C$时,${{\text{H}}_{2}}\text{S}$水溶液中各含硫微粒物质的量分数$\rm \delta$随$\rm pH$变化关系如下图$\rm 2$。

①$\rm X$由钡、硫元素组成,其晶胞结构如图$\rm 3$所示。
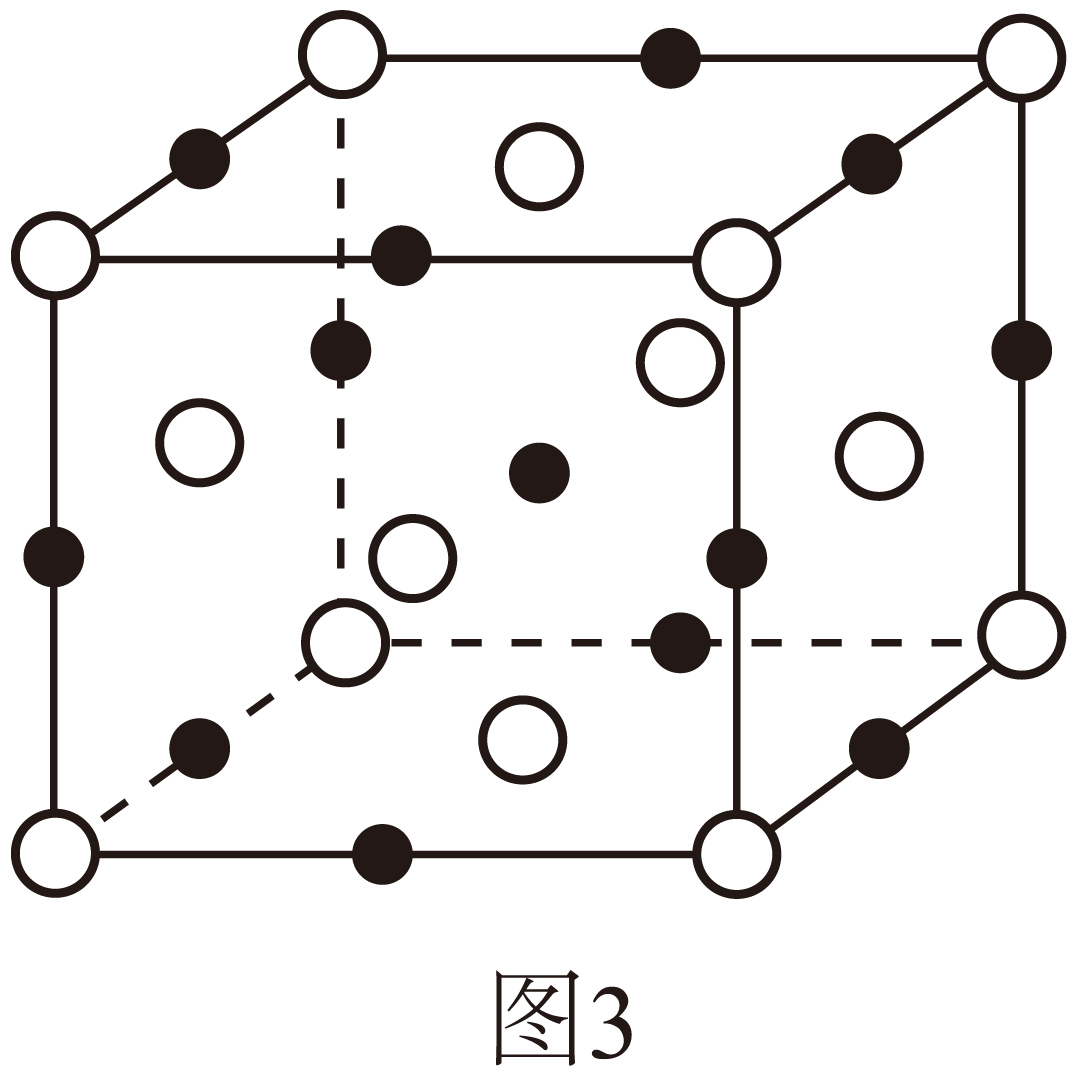
则$\rm X$的化学式为 ,每个阴离子的配位数$\rm ($紧邻的阳离子数$\rm )$是 。
②$0.01\text{ mol}\cdot {{\text{L}}^{-1}}\text{ N}{{\text{a}}_{2}}\text{S}$溶液中的含硫阴离子浓度大小$\rm ($用“$\rm \gt $”表示$\rm )$: 。
③步骤Ⅰ生成$\rm X$的化学方程式为 ;步骤Ⅴ中$\text{BaS}{{\text{O}}_{4}}$沉淀会吸附少量$\rm X$,为除去吸附的$\rm X$不用稀硫酸洗涤的原因是 ,适宜的洗涤试剂为 。
$\\rm BaS$ ; $\\rm 6$ ; $c(\\text{H}{{\\text{S}}^{-}})\\gt c({{\\text{S}}^{2-}})$ ; $\\text{BaS}{{\\text{O}}_{\\text{4}}}\\text{+4C}\\begin{matrix} \\underline{\\underline{煅烧}} \\\\ {} \\\\\\end{matrix}\\text{BaS+4CO}\\uparrow $ ; 产生有毒气体${{\\text{H}}_{2}}\\text{S}$,${{\\text{S}}^{2-}}$损失,产率降低 硫酸钠溶液$\\rm (\\text{N}{{\\text{a}}_{2}}\\text{S}{{\\text{O}}_{4}}\\rm )$
"]]①由均摊法可知,$\rm Ba$离子的数目为$8\times \dfrac{1}{8}+6\times \dfrac{1}{2}=4$,$\rm S$离子的数目为$12\times \dfrac{1}{4}+1=4$,$\rm X$的化学式为$\rm BaS$;由结构可知,每个阴离子的配位数$\rm ($紧邻的阳离子数$\rm )$是$\rm 6$;
②$0.01\text{ mol}\cdot {{\text{L}}^{-1}}\text{ N}{{\text{a}}_{2}}\text{S}$溶液中存在水解平衡,${{\text{S}}^{\text{2-}}}+{{\text{H}}_{\text{2}}}\text{O}\rightleftharpoons \text{H}{{\text{S}}^{-}}\text{+O}{{\text{H}}^{-}}$,由图可知,${{K}_{\text{a}}}_{\text{2}}={{10}^{-13}}$,${{K}_{\rm h}}=\dfrac{{{K}_{\rm w}}}{{{K}_{\rm a}}_{2}}=\dfrac{c\left( \text{H}{{\text{S}}^{-}} \right)c\left( \text{O}{{\text{H}}^{-}} \right)}{c\left( {{\text{S}}^{\text{2}}}^{-} \right)}$,${{K}_{\rm h}}=\dfrac{c\left( \text{H}{{\text{S}}^{-}} \right)c\left( \text{O}{{\text{H}}^{-}} \right)}{c\left( {{\text{S}}^{\text{2}}}^{-} \right)}=\dfrac{{{K}_{\rm w}}}{{{K}_{\rm a}}_{2}}=0.1$,$\dfrac{c\left( \text{H}{{\text{S}}^{-}} \right)}{c\left( {{\text{S}}^{\text{2}}}^{-} \right)}=\dfrac{0.1}{c\left( \text{O}{{\text{H}}^{-}} \right)}\gt 1$,故含硫阴离子浓度大小$c\text{(H}{{\text{S}}^{-}}\text{)}\gt c\text{(}{{\text{S}}^{\text{2-}}}\text{)}$;
③步骤Ⅰ硫酸钡与碳反应生成$\rm BaS$的化学方程式为$\text{BaS}{{\text{O}}_{\text{4}}}\text{+4C}\begin{matrix} \underline{\underline{煅烧}} \\ {} \\\end{matrix}\text{BaS+4CO}\uparrow $;步骤Ⅴ中$\text{BaS}{{\text{O}}_{4}}$沉淀会吸附少量$\rm BaS$,为除去吸附的$\rm BaS$不用稀硫酸洗涤的原因是$\rm BaS$与硫酸反应产生有毒气体${{\text{H}}_{2}}\text{S}$,${{\text{S}}^{2-}}$损失,产率降低,适宜的洗涤试剂为硫酸钠溶液$\rm (\text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{4}}\rm )$,不与$\rm BaS$反应,且抑制硫酸钡的溶解。
| 原子的基态与激发态、光谱题目答案及解析(完整版)
