高中 | 铁盐 亚铁盐 题目答案及解析
稿件来源:高途
高中 | 铁盐 亚铁盐题目答案及解析如下,仅供参考!
必修一
第三章 金属及其化合物
第二节 几种重要的金属化合物
铁盐 亚铁盐
溴在自然界中较为稀有,主要以盐水、海水和一些矿石形式存在,溴化合物常用于制造燃料的抗爆剂、感光剂、净水剂和染料等。某实验小组以海水为原料提取溴单质$\rm ($沸点为$\rm 58.8\;\rm ^\circ\rm C)$的工艺如图所示。
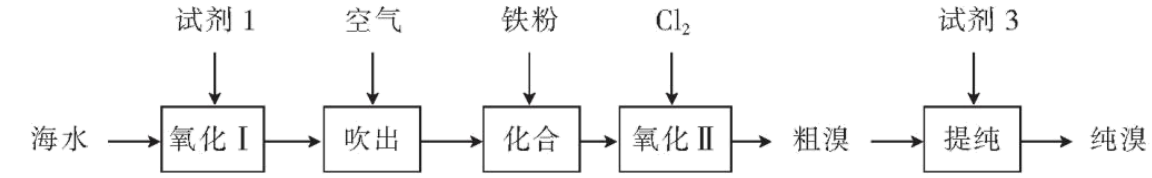
请回答下列问题:
溴位于元素周期表 区。
$\\rm p$
"]]溴元素处于元素周期表第四周期第$\rm VIIA$族,基态溴原子价层电子排布式为$4{{\text{s}}^{2}}4{{\text{p}}^{5}}$,位于元素周期表$\text{p}$区;
“氧化Ⅰ”中试剂$\rm 1$可选择“$\text{Mn}{{\text{O}}_{2}}$和稀硫酸”,其反应的离子方程式为 。
$\\text{Mn}{{\\text{O}}_{2}}+2\\text{B}{{\\text{r}}^{-}}+4{{\\text{H}}^{+}}=\\text{M}{{\\text{n}}^{2+}}+\\text{B}{{\\text{r}}_{2}}+2{{\\text{H}}_{2}}\\text{O}$
"]]二氧化锰在酸性条件下氧化$\text{B}{{\text{r}}^{-}}$生成溴单质,二氧化锰被还原成$+2$价锰离子,故离子方程式为$\rm MnO_{2}+2Br^{-}+4H^{+}=Mn^{2+}+Br_{2}+2H_{2}O$;
“吹出”中,根据溴单质 $\rm ($填性质$\rm )$,常用热空气吹出溴,达到富集溴的目的。“氧化Ⅱ”中,不同$\text{pH}$条件下,所得溶液中$\text{B}{{\text{r}}_{2}}$含量与配氯率$\left[ \eta{ =}\dfrac{{V}\left( \text{C}{{\text{l}}_{\text{2}}} \right)}{{V}\left( \text{C}{{\text{l}}_{\text{2}}} \right)} \right]$的关系如图所示。最佳条件是 。
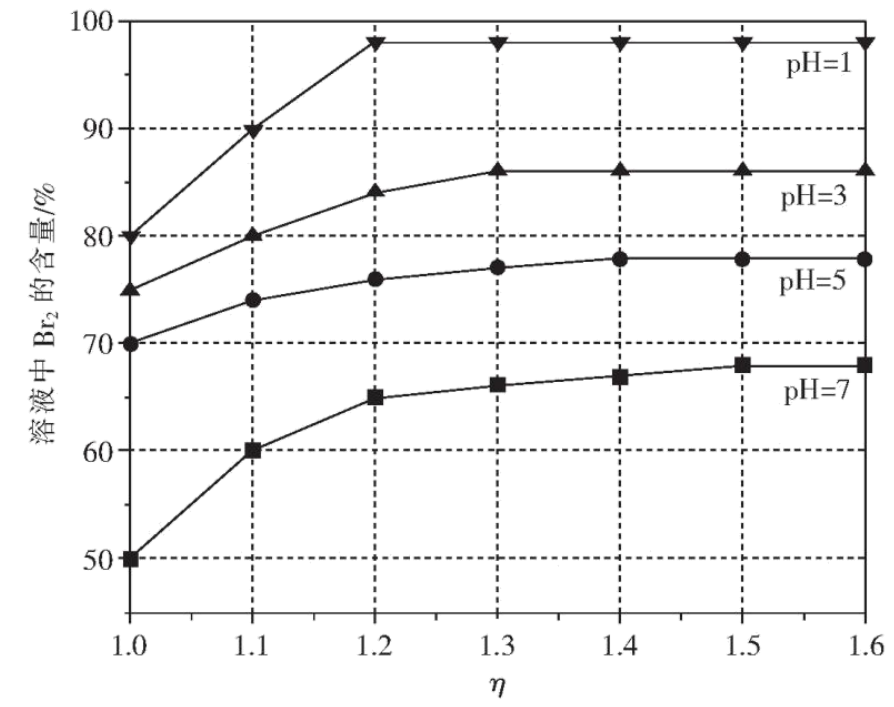
沸点低$\\rm ($或易挥发$\\rm )$ ;$\\text{pH}=1$,配氯比为$\\rm 1.2$或$\\text{pH}=1$,$\\eta\\!\\!\\text{ =1}{.2}$
"]]常温下,溴单质呈液态,沸点较低,易挥发,故采用热空气吹出溶液中溴单质。观察图像可知,配氯率为$\rm 1.2$,$\text{pH}=1$条件下$\text{B}{{\text{r}}_{2}}$含量较高;
预测“化合”中产物可能是$\text{FeB}{{\text{r}}_{3}}$,也可能是$\text{FeB}{{\text{r}}_{2}}$。下列试剂中可检验产物中是否有$\text{F}{{\text{e}}^{2+}}$的是$(\quad\ \ \ \ )$。$\rm ($填字母$\rm )$
酸性$\\text{KMn}{{\\text{O}}_{4}}$溶液
","$\\text{KSCN}$溶液
","${{\\text{K}}_{3}}\\left[ \\text{Fe}{{\\left( \\text{CN} \\right)}_{6}} \\right]$溶液
","$\\text{AgN}{{\\text{O}}_{3}}$溶液
"]如果用酸性高锰酸钾溶液,高锰酸钾能氧化溴离子影响结果判断,用$\rm KSCN$只能说明有无$\rm Fe^{3+}$而无法证明$\rm Fe^{2+}$的存在,$\rm AgNO_{3}$与$\rm Fe^{2+}$不反应;
“氧化Ⅱ”得到的粗溴中含少量$\text{C}{{\text{l}}_{2}}$,试剂$\rm 3$可能是 $\rm ($填化学式$\rm )$溶液,然后采用蒸馏操作分离溴单质。
$\\text{NaBr}\\rm ($或$\\text{KBr}\\rm )$
"]]粗溴中含少量$\text{C}{{\text{l}}_{2}}$,为了不引入新杂质,用溴化物除去粗溴中的氯气,采用蒸馏操作分离出溴单质,故试剂$\rm 3$可能是$\text{NaBr}\rm ($或$\text{KBr}\rm )$;
工业上,常用溴酸钾作氧化剂。即酸化溴离子溶液,加入$\text{KBr}{{\text{O}}_{3}}$溶液,当二者恰好完全反应时氧化产物、还原产物的物质的量之比为 。
$5:1$
"]]用溴酸钾作氧化剂,当二者恰好完全反应时发生反应$\text{BrO}_{3}^{-}+5\text{B}{{\text{r}}^{-}}+6{{\text{H}}^{+}}=\dfrac{1}{2}\text{B}{{\text{r}}_{2}}\rm ($还原产物$\rm )+\dfrac{5}{2}\text{B}{{\text{r}}_{2}}\rm ($氧化产物$\rm )+3{{\text{H}}_{2}}\text{O}$,其中氧化产物、还原产物的物质的量之比为$5:1$;
$\text{CuBr}$常用作催化剂,其立方晶胞结构如图所示,$\text{C}{{\text{u}}^{+}}$与$\text{B}{{\text{r}}^{-}}$的最近距离为 $\mathrm{nm}$。
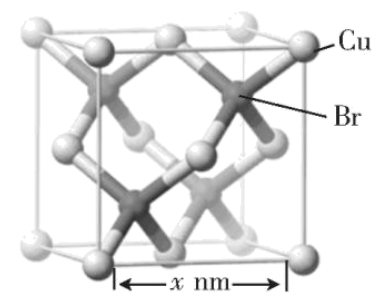
$\\dfrac{\\sqrt{\\text{3}}}{\\text{4}}{x}$
"]]由$\text{CuB}{{\text{r}}^{+}}$的晶胞可知,$\text{C}{{\text{u}}^{+}}$与$\text{B}{{\text{r}}^{-}}$的最近距离为晶胞体对角线的$\dfrac{1}{4}$,即$\dfrac{\sqrt{3}}{4}x\ \text{nm}$。
高中 | 铁盐 亚铁盐题目答案及解析(完整版)
