高中 | 摩尔质量 题目答案及解析
稿件来源:高途
高中 | 摩尔质量题目答案及解析如下,仅供参考!
必修一
第一章 从实验学化学
第二节 化学计量在实验中的应用
摩尔质量
研究含氮元素物质的反应对生产、生活、科研等方面具有重要的意义。
$Ⅰ$.回答下列问题。
汽车在行驶过程中有如下反应发生: ${{\text{N}}_{2}}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons 2\text{NO}\left( \text{g} \right) \qquad\Delta H=+180.7\ \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
$2\text{NO}\left( \text{g}\right)+2\text{CO}\left( \text{g}\right)\rightleftharpoons\text{N}_{2}\left( \text{g}\right)+2\text{C}\text{O}_{2}\left( \text{g}\right)\qquad\Delta H=-746.5\ \text{kJ}\cdot\text{mo}\text{l}^{-1}$
写出表示$\rm CO$燃烧热的热化学方程式为 。
$\\text{CO}\\left( \\text{g} \\right)+\\dfrac{1}{2}{{\\text{O}}_{\\text{2}}}\\left( \\text{g} \\right)\\text{=C}{{\\text{O}}_{\\text{2}}}\\left( \\text{g} \\right)\\qquad\\Delta H=-282.9\\;\\rm \\text{kJ}\\cdot \\text{mo}{{\\text{l}}^{-1}}$
"]]根据盖斯定律,将两个热化学方程式相加,得到$\rm CO$燃烧热的热化学方程式:$\text{CO}\left( \text{g} \right)+\dfrac{1}{2}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\text{=C}{{\text{O}}_{\text{2}}}\left( \text{g} \right)\qquad\Delta H=-282.9\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
空燃比是机动车内燃机气缸通入空气与燃料质量的比值。$\rm [$设汽油的成分为辛烷$\rm ({{\text{C}}_{8}}{{\text{H}}_{18}}\rm )$,空气的平均相对分子质量为$\rm 29$,氧气在空气中的体积分数为$\rm 21\%]$计算汽油的最佳空燃比为 $\rm ($保留三位有效数字$\rm )$。若实际空燃比大于此值,则该汽车尾气的主要污染物为 。
$\\rm 15.1$; 氮的氧化物($\\rm NO$,$\\rm NO_{2}$,${\\rm NO}_{x}$均可以)
"]]空燃比是指燃料与氧气恰好完全燃烧时的$\rm 1\;\rm kg$燃料所消耗空气的质量,首先计算氧气在空气中的质量百分含量:$\dfrac{32\times 21\%}{29}\times 100\%=23.2\%$,由$\text{C}_{\text{8}}\text{H}_{\text{18}}+\dfrac{25}{2}\text{O}_{\text{2}}\begin{matrix}\underline{\underline{点燃}}\\\\\end{matrix}\text{9}\text{H}_{\text{2}}\text{O+8C}\text{O}_{\text{2}}$可知,设消耗氧气质量为$y \ \rm kg$,则$\dfrac{114}{1\ \text{kg}}=\dfrac{\dfrac{25}{2}\times32}{{y}}$,则$y=3.5088\;\rm kg$,理想空燃比为$\dfrac{\text{3.5088 kg}}{\text{23.2 }\%}=\text{15.1 kg}$,若实际空燃比大于此值,则该汽车尾气的主要污染物为氮的氧化物;
在汽车上安装三元催化转化器可实现反应:$2\text{NO}\left( \text{g} \right)+2\text{CO}\left( \text{g} \right)\rightleftharpoons {{\text{N}}_{2}}\left( \text{g} \right)+2\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\qquad\Delta H\rm \lt 0$,减少汽车尾气污染。$T\ ^\circ\rm C$时,在恒容的密闭容器中通入一定量的$\rm CO$和$\rm NO$,能进行上述反应,测得不同时间的$\rm CO$和$\rm NO$的浓度如表:
| 时间$\rm /s$ | $\rm 0$ | $\rm 1$ | $\rm 2$ | $\rm 3$ | $\rm 4$ | $\rm 5$ | $\rm 6$ |
| $c\left( \text{NO} \right)/{{10}^{-3}}\ \text{mol}\cdot {{\text{L}}^{-1}}$ | $\rm 1.50$ | $\rm 1.15$ | $\rm 0.75$ | $\rm 0.62$ | $\rm 0.55$ | $\rm 0.50$ | $\rm 0.50$ |
| $c\left( \text{CO} \right)/{{10}^{-3}}\ \text{mol}\cdot {{\text{L}}^{-1}}$ | $\rm 3.00$ | $\rm 2.65$ | $\rm 2.25$ | $\rm 2.12$ | $\rm 2.05$ | $\rm 2.00$ | $\rm 2.00$ |
该反应在$\rm 1\sim 4s$内的平均反应速率为$v\left( \text{NO} \right)=$ 。反应达平衡时压强为$\rm 100\;\rm kPa$,求压强平衡常数$K_{\text{p}}=$ $\text{kP}{{\text{a}}^{-1}}$。$(K_{\text{p}}$用平衡分压代替平衡浓度,分压$\rm =$总压$\rm \times $物质的量分数$\rm )$
$\\rm 2.0\\times 10^{-4}\\;\\rm mol·L^{-1}·s^{-1}$;$\\rm ·$ $\\rm 2.0\\times 10^{-2}$;
"]]$\rm 1\sim 4s$平均反应速率为$v\left({\rm NO} \right)=\dfrac{\Delta c}{\Delta t}=\dfrac{\left( 1.15-0.55 \right)\times {{10}^{-3}}\;\rm \text{mol}\cdot {{\text{L}}^{-1}}}{\left( 4-1 \right)\text{s}}=2.0\times {{10}^{-4}}\;\rm \text{mol}\cdot {{\text{L}}^{-1}}\cdot {{\text{s}}^{-1}}$,反应达到平衡后,根据三段式计算各组分产物浓度:
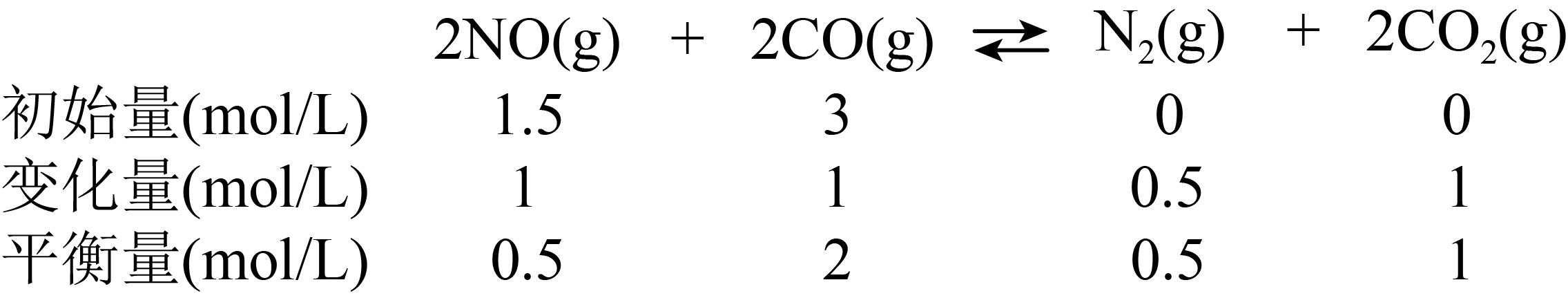
根据平衡时压强为$\rm 100\;\rm kPa$,计算得到四种组分分压分别为$\dfrac{1}{8}\times 100\;\rm kPa$,$\dfrac{4}{8}\times 100\;\rm kPa$,$\dfrac{1}{8}\times 100\;\rm kPa$和$\dfrac{2}{8}\times 100\;\rm kPa$,由$\rm \textit{K}_p=\dfrac{\left( \dfrac{1}{8}\times 100\;\rm kPa \right)\times {{\left( \dfrac{1}{8}\times 100\;\rm kPa \right)}^{2}}}{{{\left( \dfrac{4}{8}\times 100\;\rm kPa \right)}^{2}}\times {{\left( \dfrac{1}{8}\times 100\;\rm kPa \right)}^{2}}}=2\times {{100}^{-2}}$。
$Ⅱ$$.$工业合成氨以铁触媒作催化的反应机理如图$($*表示吸附态,中间部分表面反应过程未标出$)$: 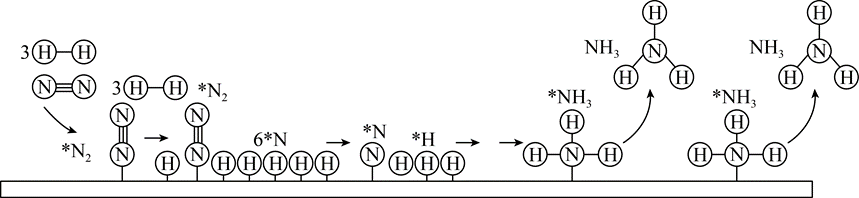
已知:${{\text{N}}_{2}}$的吸附分解反应活化能高、速率慢,决定了合成氨的整体反应速率。
研究表明,合成氨的速率与相关物质的浓度关系为$v=k\cdot c\left( \text{N}_{2}\right)\cdot c^{\frac{3}{2}}\left( \text{H}_{2}\right)\cdot c^{-1}\left( \text{N}\text{H}_{3}\right)$,$k$为速率常数。以下说法正确的是$(\quad\ \ \ \ )$。
合成氨的反应在任意温度下都能自发进行
","增大${{\\text{N}}_{2}}$、${{\\text{H}}_{2}}$或$\\text{N}{{\\text{H}}_{3}}$的浓度都能提高合成氨速率
","若反应气中混有水蒸气,$\\rm Fe$催化剂可能中毒
","使用催化剂可提高单位时间内原料气的转化率
"]$\rm A$.合成氨的反应$\Delta H\lt 0$,$\Delta \text{S}\lt 0$,在低温下自发进行,$\rm A$错误;
$\rm B$. 减小$\rm NH_{3}$的浓度能提高合成氨速率,$\rm B$错误;
$\rm C$.若反应气中混有水蒸气,可能导致$\rm Fe$催化剂中毒,$\rm C$正确;
$\rm D$.使用催化剂可提高单位时间内原料气的转化率,$\rm D$正确;
故选:$\rm CD$;
实际工业生产中,原料气中${{\text{N}}_{2}}$和${{\text{H}}_{2}}$物质的量之比按$\rm 1:2.8$加入。请说明原料气中${{\text{N}}_{2}}$过量的理由:$\rm ($从两种不同的角度分析$\rm )$ 。
$\\rm N_{2}$原料易得,适度过量有利于提高氨气转化率;$\\rm N_{2}$在$\\rm Fe$催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率;
"]]工业合成氨反应为:$\rm \text{3}\text{H}_{\text{2}}+\text{N}_{\text{2}}\overset{高温、高压}{\underset{催化剂}{\rightleftharpoons}}2N\text{H}_{\text{3}}$,在实际生产中,原料氮气稍过量,从促进平衡移动角度分析,原料气中氮气相对易得,过量氮气有利于提高氨气的转化率;同时根据上述反应机理图可知,$\rm N_{2}$在$\rm Fe$催化剂上的吸附是决速步骤,适度过量有利于提高整体反应速率;
在氨气催化氧化制硝酸过程中,发现$2\text{NO}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons 2\text{N}{{\text{O}}_{2}}\left( \text{g} \right) (\Delta H\rm \lt 0)$反应的速率随温度的升高而减小。某化学小组查阅资料得知该反应的反应历程分两步:
①$2\text{NO}\left( \text{g} \right)\rightleftharpoons {{\text{N}}_{2}}{{\text{O}}_{2}}\left( \text{g} \right)\rm ($快$\rm )$ $\qquad\Delta H_{1}\lt0$
②${{\text{N}}_{2}}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons 2\text{N}{{\text{O}}_{2}}\left( \text{g} \right)\rm ($慢$\rm )$ $\qquad\Delta H_{2}\lt0$
根据化学反应原理解释升高温度该反应速率减小的原因可能是 。
温度升高,快反应①平衡逆向移动,$\\rm \\textit{c}(N_{2}O_{2})$降低,导致慢反应 (决速步骤)②的反应物浓度减小,速率减慢,$\\rm NO_{2}$的生成速率降低。
"]]由题意知,升高温度该反应速率减小。根据两步反应历程可推测:温度升高,快反应①平衡逆向移动,$ c\rm(N_{2}O_{2})$降低,导致慢反应 (决速步骤)②的反应物浓度减小,速率减慢,故$\rm NO_{2}$的生成速率降低。
高中 | 摩尔质量题目答案及解析(完整版)
