高中 | 杂化轨道理论 题目答案及解析
稿件来源:高途
高中 | 杂化轨道理论题目答案及解析如下,仅供参考!
选修三
第二章 分子结构与性质
第二节 分子的立体结构
杂化轨道理论
锰氧化物具有较大应用价值,回答下列问题:
$\text{Mn}$在元素周期表中位于第 周期 族;同周期中,基态原子未成对电子数比$\text{Mn}$多的元素是 $\rm ($填元素符号$\rm )$。
四;Ⅶ$\\rm B$;$\\rm Cr$
"]]$\rm Mn$的原子序数为$\rm 25$,位于元素周期表第四周期Ⅶ$\rm B$族;基态$\rm Mn$的电子排布式为:$\left[ \text{Ar} \right]3{{\text{d}}^{5}}4{{\text{s}}^{2}}$,未成对电子数有$\rm 5$个,同周期中,基态原子未成对电子数比$\rm Mn$多的元素是$\rm Cr$,基态$\rm Cr$的电子排布式为$\left[ \text{Ar} \right]3{{\text{d}}^{5}}4{{\text{s}}^{1}}$,有$\rm 6$个未成对电子;
$\text{Mn}$如某种氧化物$\text{Mn}{{\text{O}}_{ {x}}}$的四方晶胞及其在$ xy$平面的投影如图所示,该氧化物化学式为 。
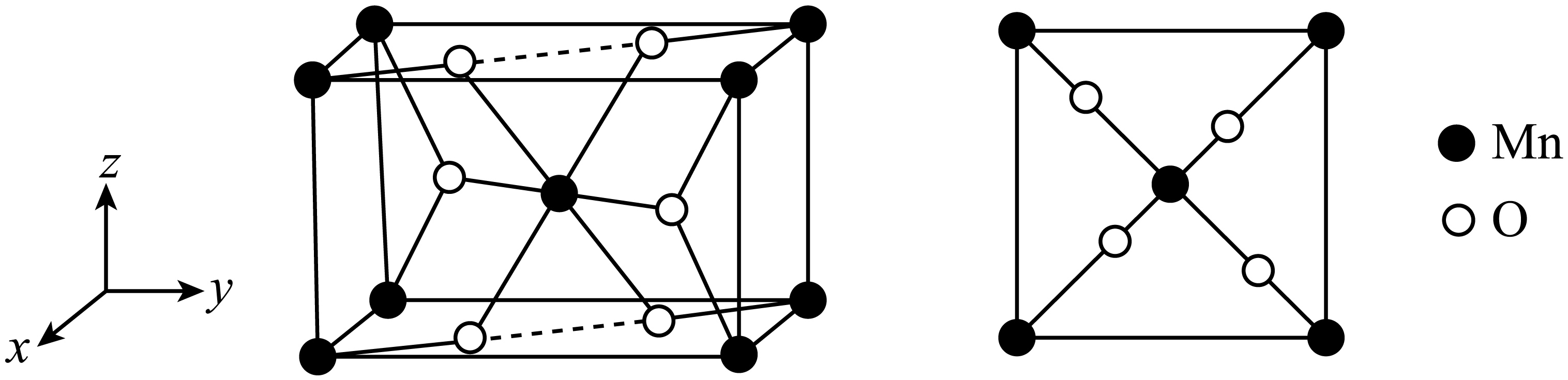
当$\text{Mn}{{\text{O}}_{ {x}}}$晶体有$\rm O$原子脱出时,出现$\rm O$空位,$\text{Mn}$的化合价 $\rm ($填“升高”“降低”或“不变”$\rm )$,$\rm O$空位的产生使晶体具有半导体性质。下列氧化物晶体难以通过该方式获有半导体性质的是 $\rm ($填标号$\rm )$。
$\rm A$.$\rm \text{CaO}$ $\rm B$.$\rm {{\text{V}}_{\text{2}}}{{\text{O}}_{\text{5}}}$ $\rm C$.$\rm \text{F}{{\text{e}}_{\text{2}}}{{\text{O}}_{\text{3}}}$ $\rm D$.$\rm \text{CuO}$
$\\rm MnO_{2}$;降低;$\\rm A$
"]]由均摊法得,晶胞中$\rm Mn$的数目为$1+8\times \dfrac{1}{8}=2$,$\rm O$的数目为$2+4\times \dfrac{1}{2}=4$,即该氧化物的化学式为$\rm MnO_{2}$;$\text{Mn}{{\text{O}}_{ {x}}}$晶体有$\rm O$原子脱出时,出现$\rm O$空位,即$x$减小,$\text{Mn}$的化合价为$ +2x$,即$\rm Mn$的化合价降低;$\rm CaO$中$\rm Ca$的化合价为$\rm +2$价、$\rm V_{2}O_{5}$中$\rm V$的化合价为$\rm +5$价、$\rm Fe_{2}O_{3}$中$\rm Fe$的化合价为$\rm +3$、$\rm CuO$中$\rm Cu$的化合价为$\rm +2$,其中$\rm CaO$中$\rm Ca$的化合价下降只能为$\rm 0$,其余可下降得到比$\rm 0$大的价态,说明$\rm CaO$不能通过这种方式获得半导体性质;
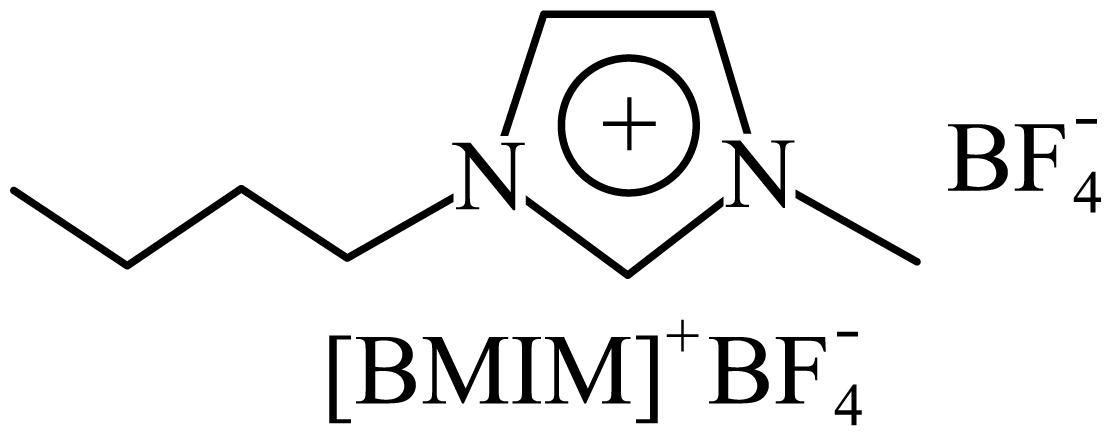
$\rm {{[{ BMIM }]{ }}^{+}}{BF}_{{4}}^{-}\rm ($见图$\rm )$是${\rm {Mn}{{{O}}}}_{{x}}$晶型转变的诱导剂。$\rm {BF}_{{4}}^{-}$的空间构型为 ;$\rm {{{ }[{ BMIM }]{ }}^{+}}$中咪唑环存在$\rm \pi{ }_{5}^{6}$大$\rm \pi{ }$键,则$\rm N$原子采取的轨道杂化方式为 。
正四面体形;$\\rm sp^{2}$
"]]$\text{BF}_{\text{4}}^{-}$中$\rm B$形成$\rm 4$个$\rm \sigma$键(其中有$\rm 1$个配位键),为$\rm sp^{3}$杂化,空间构型为正四面体形;咪唑环存在$ \pi_{5}^{6}$大$\pi $键,$\rm N$原子形成$\rm 3$个$\rm \sigma$键,杂化方式为$\rm sp^{2}$;
$\text{Mn}{{\text{O}}_{\text{x}}}$可作$\text{HMF}$转化为$\text{FDCA}$的催化剂$\rm ($见下图$\rm )$。$\text{FDCA}$的熔点远大于$\text{HMF}$,除相对分子质量存在差异外,另一重要原因是 。
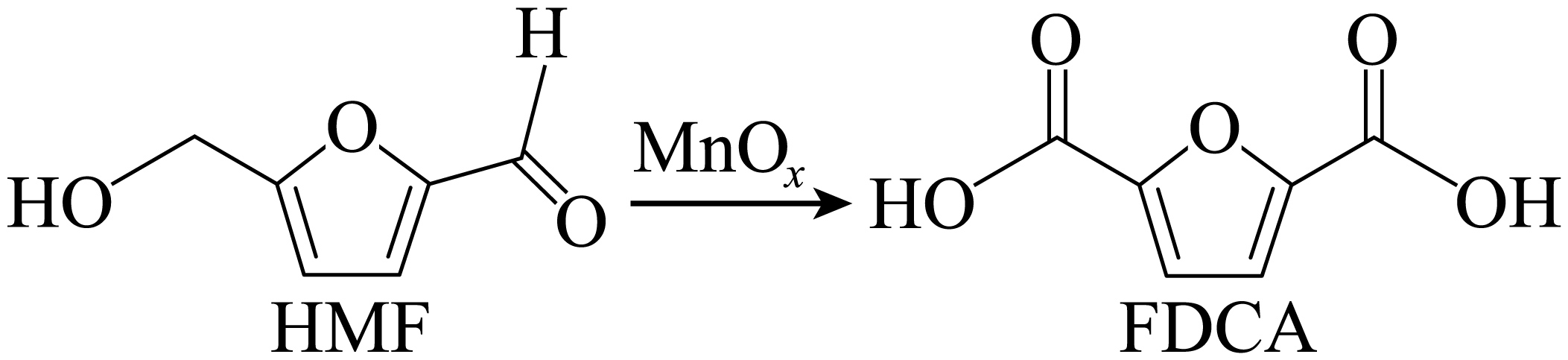
$\\rm FDCA$形成的分子间氢键更多
"]]由$\rm HMF$和$\rm FDCA$的结构可知,$\rm HMF$和$\rm FDCA$均能形成分子间氢键,但$\rm FDCA$形成的分子间氢键更多,使得$\rm FDCA$的熔点远大于$\rm HMF$。
高中 | 杂化轨道理论题目答案及解析(完整版)
