| 铁盐 亚铁盐 题目答案及解析
稿件来源:高途
| 铁盐 亚铁盐题目答案及解析如下,仅供参考!
必修一
第三章 金属及其化合物
第二节 几种重要的金属化合物
铁盐 亚铁盐
高铁酸钾$\rm (K_{2}FeO_{4})$可作为水处理剂和高容量电池材料。实验室模拟湿法制备高铁酸钾的流程如下:
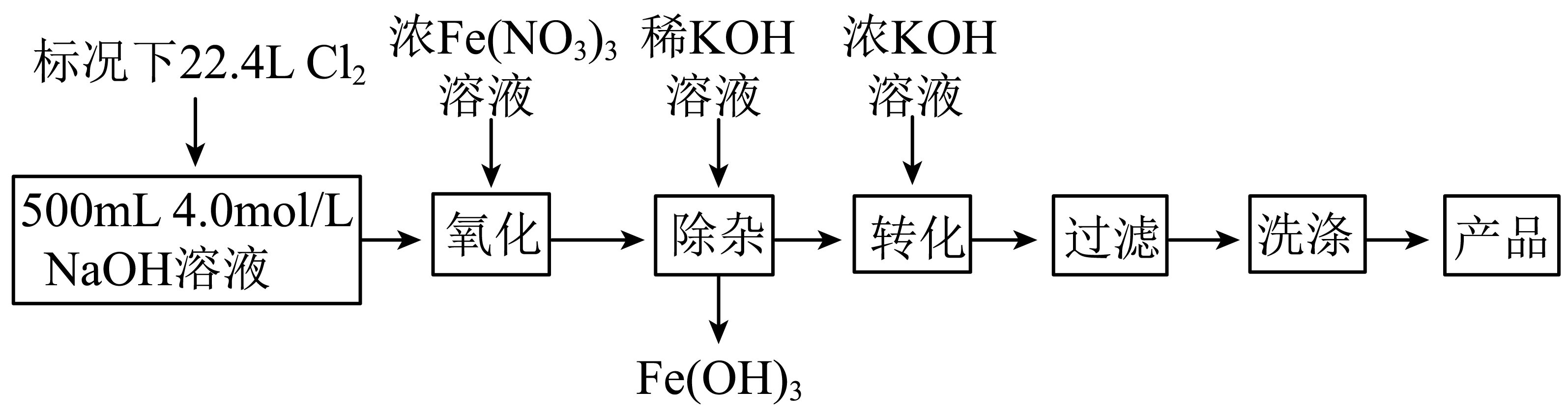
已知:“转化”过程发生复分解反应。
用$\rm NaOH$固体配制上述$\rm NaOH$溶液,下列操作错误的有 $\rm ($填序号$\rm )$。
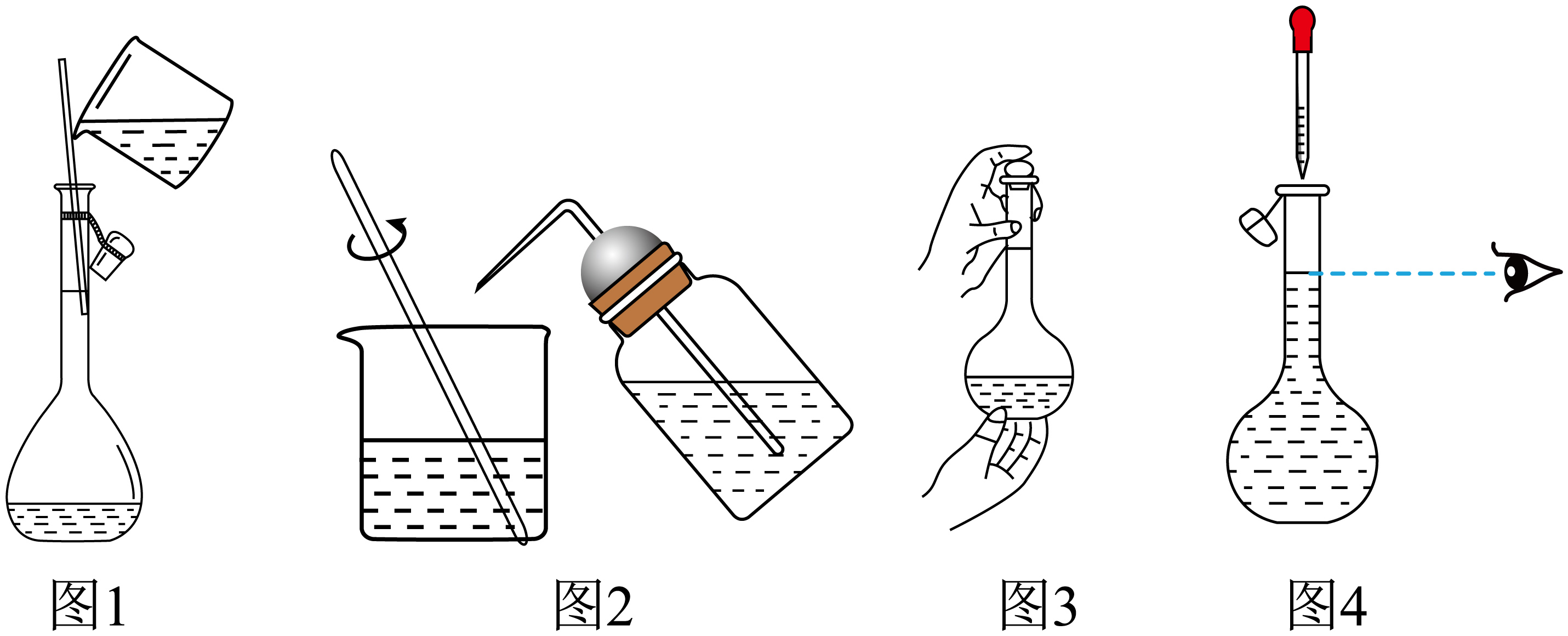
$\rm A$.图$\rm 1$溶解$\rm NaOH$固体 $\rm B$.图$\rm 2$用蒸馏水洗涤烧杯和玻璃棒
$\rm C$.图$\rm 3$上下颠倒摇匀 $\rm D$.图$\rm 4$定容
$\\rm AC$
"]]$\rm A$.不能在容量瓶中溶解$\rm NaOH$固体配制溶液,应该在烧杯中溶解,$\rm A$错误;
$\rm B$.为避免造成溶质损失带来误差,转移溶液后的烧杯和玻璃棒应该要用蒸馏水洗涤,并且将洗涤液全部转移至容量瓶中,$\rm B$正确;
$\rm C$.图$\rm 3$为初步摇匀过程,不能将容量瓶倒转振荡摇匀,$\rm C$错误;
$\rm D$.定容时,用胶头滴管滴加水,视线与刻度线持平,$\rm D$正确;
答案选$\rm AC$。
配制上述$\rm NaOH$溶液,下列操作可能导致溶液浓度偏大的是 $\rm ($填序号$\rm )$。
$\rm A$.容量瓶洗净之后未干燥 $\rm B$.$\rm NaOH$在烧杯中溶解后,烧杯未洗涤
$\rm C$.定容时俯视刻度线 $\rm D$.上下颠倒摇匀后发现液面低于刻度线,再加水至刻度线
$\\rm C$
"]]$\rm A$.容量瓶洗净之后未干燥对溶液浓度无影响,因为定容时,也需要加入水,所以不影响溶液浓度,$\rm A$不符合题意;
$\rm B$.$\rm NaOH$在烧杯中溶解后,烧杯未洗涤,导致溶质损失,溶液浓度偏小,$\rm B$不符合题意;
$\rm C$.定容时俯视刻度线,会导致定容时加水量减少,浓度偏大,$\rm C$符合题意;
$\rm D$.摇匀后发现液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏小,$\rm D$不符合题意;
答案选$\rm C$
$\rm NaOH$溶液应置于冰水浴中,否则温度升高将发生副反应。
主反应:$\rm Cl_{2}+2NaOH=NaCl+NaClO+H_{2}O$
副反应:$\text{C}{{\text{l}}_{2}}+\text{NaOH}\to \text{NaCl}+\text{NaCl}{{\text{O}}_{3}}+{{\text{H}}_{2}}\text{O}\rm ($未配平$\rm )$
①配平上述副反应:
$\rm Cl_{2}+$ $\rm NaOH=$ $\rm NaCl+$ $\rm NaClO_{3}+$ $\rm H_{2}O$
②若有$0.15\text{ mol C}{{\text{l}}_{2}}$发生上述副反应,该副反应转移电子的物质的量为 $\rm \;\rm mol$;
$\\rm 3Cl_{2}+6NaOH=5NaCl+NaClO_{3}+3H_{2}O$ ; $\\rm 0.25$
"]]①在$\text{C}{{\text{l}}_{2}}+\text{NaOH}\to \text{NaCl}+\text{NaCl}{{\text{O}}_{3}}+{{\text{H}}_{2}}\text{O}$的反应中,发生氧化还原反应,化合价变化的元素均是氯元素。氯气生成产物$\rm NaCl{{O}_{3}}$,氯元素化合价从$\rm 0$价升高到$\rm +5$价,失去$\rm 5{{\text{e}}^{-}}$;同时氯气生成产物$\rm NaCl$,氯元素化合价从$\rm 0$价降低到$\rm -1$价,得到$\rm 1{{\text{e}}^{-}}$,根据电子转移守恒规律,则$\rm NaCl$的计量系数为$\rm 5$,$\rm NaCl{{O}_{3}}$的计量系数为$1$,最后通过观察法配平。
②根据$\text{3 mol C}{{\text{l}}_{\text{2}}}\sim 5\text{ mol }{{\text{e}}^{-}}$,根据比例,即可求出$0.15\text{ mol C}{{\text{l}}_{2}}$发生上述副反应,该副反应转移电子的物质的量为$\rm 0.25\text{ }mol\text{ }{{e}^{-}}$;
“氧化”过程中溶液保持强碱性,写出反应的离子方程式: 。
$3\\text{Cl}{{\\text{O}}^{-}}+2\\text{F}{{\\text{e}}^{3+}}+10\\text{O}{{\\text{H}}^{-}}=2\\text{FeO}_{4}^{2-}+3\\text{C}{{\\text{l}}^{-}}+5{{\\text{H}}_{2}}\\text{O}$
"]]$\rm {{\text{K}}_{2}}Fe{{O}_{4}}$中$\rm Fe$元素为$\rm +6$价,氧化过程$\rm Fe$元素化合价升高,由$\rm +3$价升高到$\rm +6$价,被氧化,$\rm Cl$元素化合价由$\rm +1$价降低到$\rm -1$价,被还原,反应的离子方程式为:$\rm 3Cl{{O}^{-}}+2F{{e}^{3+}}+10O{{H}^{-}}=2FeO_{4}^{2-}+3C{{l}^{-}}+5{{\text{H}}_{2}}\text{O}$;
写出“转化”的化学方程式 。
$\\rm \\text{N}{{\\text{a}}_{2}}\\text{Fe}{{\\text{O}}_{4}}+2\\text{KOH}={{\\text{K}}_{2}}\\text{Fe}{{\\text{O}}_{4}}\\downarrow +2\\text{NaOH}$
"]]“转化”是往$\rm N{{a}_{2}}Fe{{O}_{4}}$中加入$\rm KOH$,可以制得$\rm {{\text{K}}_{2}}Fe{{O}_{4}}$;
高铁酸钾是一种新型的自来水处理剂,它的性质和作用是 $\rm ($填序号$\rm )$。
$\rm A$.有强还原性,可消毒杀菌,氧化产物水解后能吸附水中杂质
$\rm B$.有强氧化性,可消毒杀菌,还原产物水解后能吸附水中杂质
$\rm C$.有强还原性,能吸附水中杂质,氧化产物能消毒杀菌
$\rm D$.有强氧化性,能吸附水中杂质,还原产物能消毒杀菌
$\\rm B$
"]]$\rm A$.高铁酸钾作氧化剂使用,体现了氧化性,铁元素化合价降到$\rm +3$价,形成$\rm F{{e}^{3+}}$,铁元素被还原。利用其水解产生的氢氧化亚铁胶体的吸附作用,除去杂质,不是利用其氧化产物除杂,$\rm A$错误;
$\rm B$.在高铁酸钾的使用过程中,铁元素被还原产生$\rm F{{e}^{3+}}$,利用其水解产生的氢氧化亚铁胶体的吸附作用,除去杂质,$\rm B$正确;
$\rm C$.高铁酸钾具有强氧化性,还原产物水解后能吸附水中杂质,$\rm C$错误;
$\rm D$.高铁酸钾有强氧化性,不能直接吸附水中杂质,其还原产物不能消毒杀菌,$\rm D$错误;
答案选$\rm B$。
工业干法制备高铁酸钾的第一步反应为:$2\text{FeS}{{\text{O}}_{4}}+6\text{N}{{\text{a}}_{2}}{{\text{O}}_{2}}\begin{matrix} \underline{\underline{_{\triangle }}} \\ {} \\ \end{matrix}2\text{N}{{\text{a}}_{2}}\text{Fe}{{\text{O}}_{4}}+2\text{N}{{\text{a}}_{2}}\text{O}+2\text{N}{{\text{a}}_{2}}\text{S}{{\text{O}}_{4}}+{{\text{O}}_{2}}\uparrow $,该反应中氧化产物为 、 。
$\\rm O_{2}$ ; $\\rm \\text{N}{{\\text{a}}_{\\text{2}}}\\text{Fe}{{\\text{O}}_{\\text{4}}}$
"]]根据化合价变化规律,此反应中,化合价升高所对应的产物是$\rm N{{a}_{2}}Fe{{O}_{4}}$和$\rm {{\text{O}}_{2}}$。
| 铁盐 亚铁盐题目答案及解析(完整版)
