高中 | 萃取与分液 题目答案及解析
稿件来源:高途
高中 | 萃取与分液题目答案及解析如下,仅供参考!
必修一
第一章 从实验学化学
第一节 化学实验基本方法
萃取与分液
工业上常采用堆浸$\rm —$反萃取$\rm —$电积法从锌矿$\rm ($主要成分为${\mathrm{ZnS}}$,含有$\text{Fe}{{\text{S}}_{2}}$、$\text{CuS}$、$\text{NiS}$、$\text{Si}{{\text{O}}_{2}}$等杂质$\rm )$中获得锌,其流程如图所示:
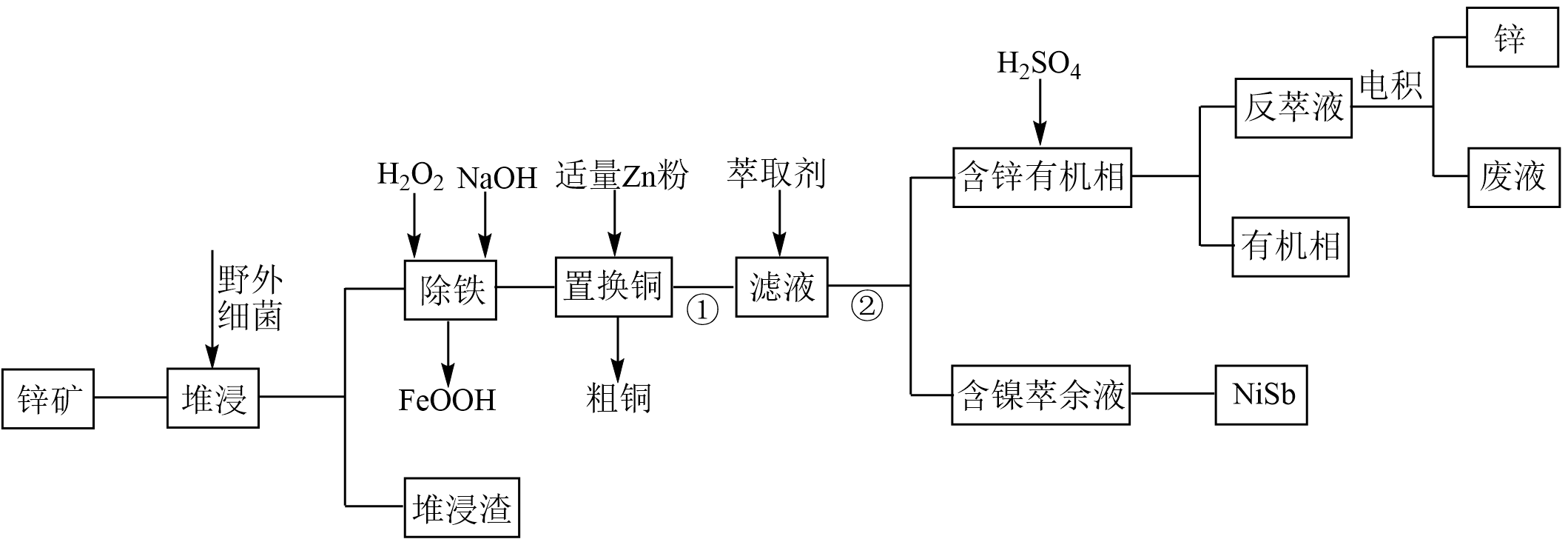
已知:①“堆浸”时金属硫化物均转化为硫酸盐;②$\rm pH$较高时,氢氧化氧铁为胶状沉淀。
请回答下列问题:
“堆浸渣”的主要成分为 ,“堆浸”时为提高反应速率,可采取的措施为 $\rm ($填序号$\rm )$。
$\rm A$.延长堆浸时间 $\rm B$.将锌矿粉碎 $\rm C$.大幅升温 $\rm D$.将锌矿充分暴露
$\\rm SiO_{2}$;$\\rm BD$
"]]“堆浸渣”的主要成分为:$\rm SiO_{2}$;“堆浸”时为提高反应速率,可采取的措施为:将锌矿充分粉碎和充分暴露可提高反应速率,延长反应时间不会提高反应速率,大幅升温成本太高,故选:$\rm BD$。
流程中①和②的操作名称分别为 、 。
过滤;分液
"]]根据分析,流程中①和②的操作名称分别为过滤、分液。
“除铁”时主要发生反应的离子方程式为 。“除铁”时,$\rm pH$对不同金属离子沉淀率的影响如图所示。“除铁”时最合理的$\rm pH$约为 。事实上$\text{Z}{{\text{n}}^{2+}}$、$\text{C}{{\text{u}}^{2+}}$、$\text{N}{{\text{i}}^{2+}}$在$\text{pH}\leqslant 6$时难以沉淀,但是有铁离子存在时,$\rm pH$升高,$\text{Z}{{\text{n}}^{2+}}$、$\text{C}{{\text{u}}^{2+}}$、$\text{N}{{\text{i}}^{2+}}$的沉淀率均升高,原因可能为 。
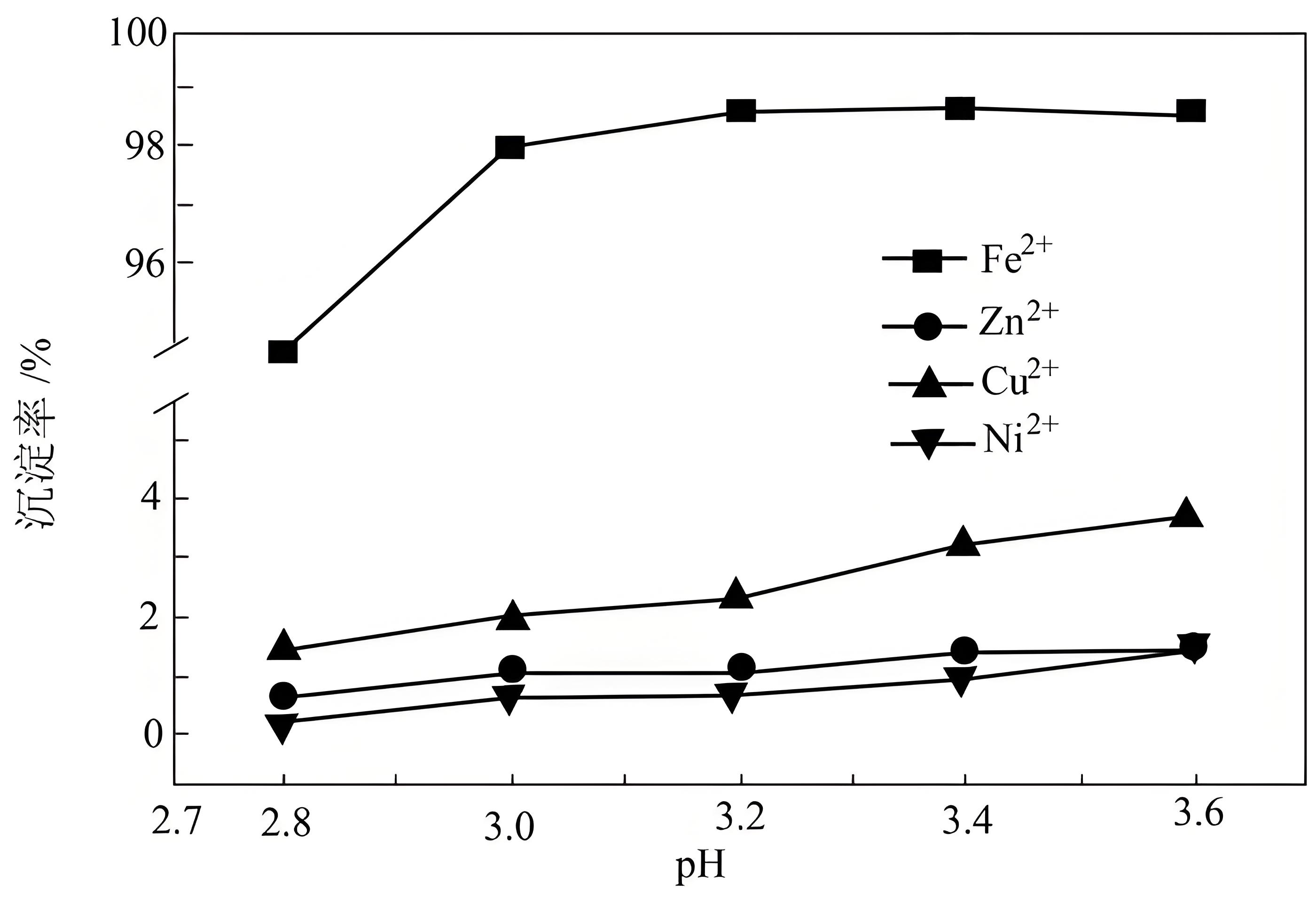
$2\\text{F}{{\\text{e}}^{2+}}+{{\\text{H}}_{2}}{{\\text{O}}_{2}}+4\\text{O}{{\\text{H}}^{-}}\\text{=FeOOH}\\downarrow +2{{\\text{H}}_{2}}\\text{O}$;$\\rm 3.0$或$\\rm 3.2$均可;生成的氢氧化氧铁胶状沉淀有较强吸附性,可将$\\text{Z}{{\\text{n}}^{2+}}$、$\\text{C}{{\\text{u}}^{2+}}$、$\\text{N}{{\\text{i}}^{2+}}$吸附而使其沉淀
"]]加入双氧水氧化亚铁离子利用氢氧化钠除铁得到$\rm FeOOH$ ,故“除铁”时主要发生反应的离子方程式为:$2\text{F}{{\text{e}}^{2+}}+{{\text{H}}_{2}}{{\text{O}}_{2}}+4\text{O}{{\text{H}}^{-}}\text{=FeOOH}\downarrow +2{{\text{H}}_{2}}\text{O}$;除铁时选择的$\rm pH$值是:$\rm 3.0$或$\rm 3.2$均可,此范围铁离子沉淀率高,其他离子沉淀率低;有铁离子存在时,$\rm pH$升高,$\text{Z}{{\text{n}}^{2+}}$、$\text{C}{{\text{u}}^{2+}}$、$\text{N}{{\text{i}}^{2+}}$的沉淀率均升高,原因可能为:生成的氢氧化氧铁胶状沉淀有较强吸附性,可将$\text{Z}{{\text{n}}^{2+}}$、$\text{C}{{\text{u}}^{2+}}$、$\text{N}{{\text{i}}^{2+}}$吸附而使其沉淀。
“置换镍”时用锌粉直接置换速率极小,目前采用“锑盐净化法’置换,即置换时在酸性含$\text{N}{{\text{i}}^{2+}}$溶液中同时加入锌粉和$\text{S}{{\text{b}}_{2}}{{\text{O}}_{3}}$,得到合金$\text{NiSb}$的总反应的离子方程式为 。
$2\\text{N}{{\\text{i}}^{2+}}+\\text{S}{{\\text{b}}_{2}}{{\\text{O}}_{3}}+6{{\\text{H}}^{+}}+5\\text{Zn=}2\\text{NiSb}+3{{\\text{H}}_{2}}\\text{O}+5\\text{Z}{{\\text{n}}^{2+}}$
"]]根据题意,得到合金$\text{NiSb}$的总反应的离子方程式为:$2\text{N}{{\text{i}}^{2+}}+\text{S}{{\text{b}}_{2}}{{\text{O}}_{3}}+6{{\text{H}}^{+}}+5\text{Zn=}2\text{NiSb}+3{{\text{H}}_{2}}\text{O}+5\text{Z}{{\text{n}}^{2+}}$。
反萃液“净化”后的“滤液”加入阴极室内进行“电沉积”可得到纯锌,电解原理如图所示。
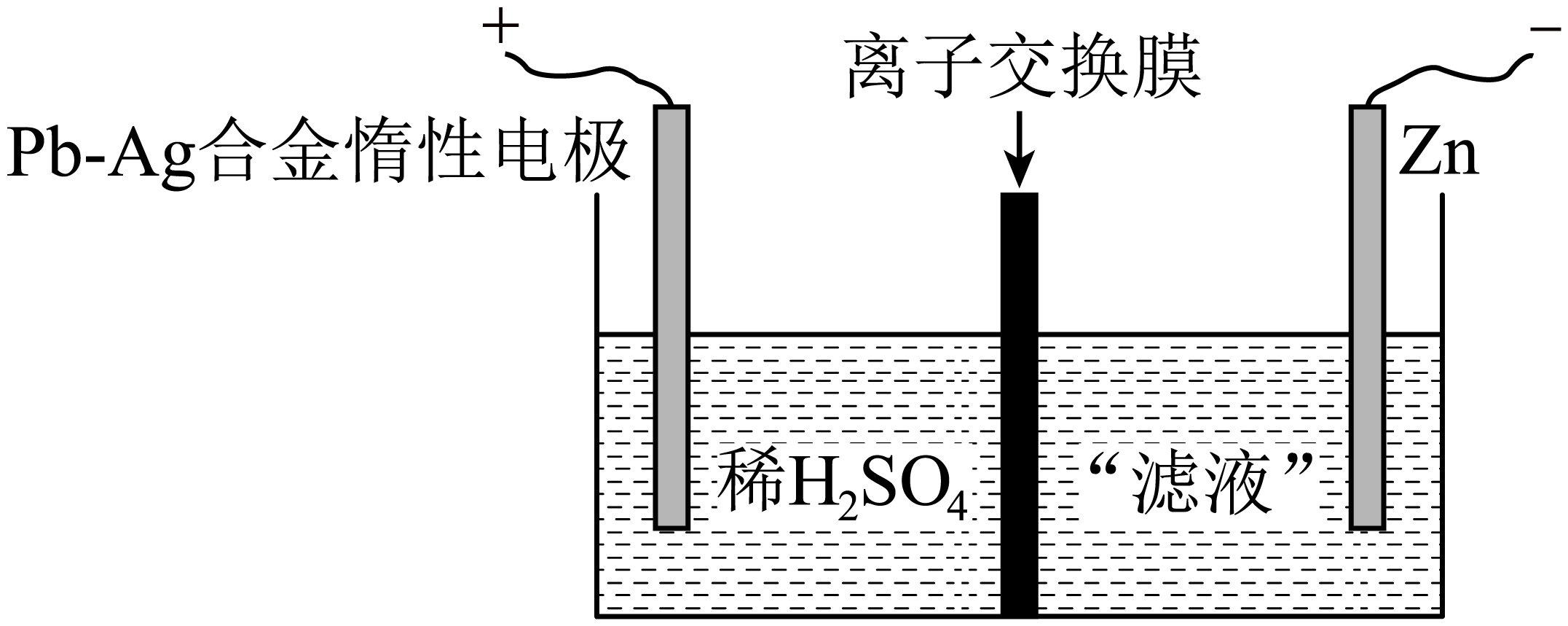
①图中“离子交换膜”为 $\rm ($填“阴”或“阳”$\rm )$离子交换膜。
②阳极的电极反应式为 。
阴;$2{{\\text{H}}_{2}}\\text{O}-4{{\\text{e}}^{-}}={{\\text{O}}_{2}}\\uparrow +4{{\\text{H}}^{+}}$
"]]净化后的滤液中含有$\rm ZnSO_{4}$,电解时阳极水失去电子生成氧气和氢离子,电极式为:$2{{\text{H}}_{2}}\text{O}-4{{\text{e}}^{-}}={{\text{O}}_{2}}\uparrow +4{{\text{H}}^{+}}$,阴极锌离子得电子生成$\rm Zn$,离子交换膜为阴离子交换膜,硫酸根通过阴离子交换膜移向阳极。故离子交换膜为阴离子交换膜,阳极电极式为:$2{{\text{H}}_{2}}\text{O}-4{{\text{e}}^{-}}={{\text{O}}_{2}}\uparrow +4{{\text{H}}^{+}}$。
高中 | 萃取与分液题目答案及解析(完整版)
