高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
测定平衡常数对定量认识化学反应具有重要意义。已知:${{\text{I}}_{2}}$能与$\mathrm{I}^{-}$反应生成$\text{I}_{3}^{-}$,在水溶液中建立平衡:${{\text{I}}_{2}}+{{\text{I}}^{-}}\rightleftharpoons \text{I}_{3}^{-}$。通过测定平衡体系中的${c}\left( {{\text{I}}_{\text{2}}} \right)$、${c}\left( {{\text{I}}^{{-}}} \right)$和${c}\left( \text{I}_{\text{3}}^{{-}} \right)$,就可求得该反应的平衡常数。
Ⅰ.同学甲为测定上述平衡体系中${c}\left( {{\text{I}}_{\text{2}}} \right)$,采取如下方法:取${{ {V}}_{\text{1}}}$ $\rm mL$上述平衡体系的混合溶液,用$c\;\mathrm{mol} \cdot \mathrm{L}^{-1}$的$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$溶液进行滴定
[反应原理:${{\text{I}}_{2}}+2\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}=2\text{NaI}+\text{N}{{\text{a}}_{2}}{{\text{S}}_{4}}{{\text{O}}_{6}}$],消耗$\text{N}{{\text{a}}_{2}}{{\text{S}}_{2}}{{\text{O}}_{3}}$溶液${{ {V}}_{\text{2}}}\;\rm mL$。根据${{ {V}}_{\text{1}}}$、${{ {V}}_{\text{2}}}$和$c$可求得${c}\left( {{\text{I}}_{\text{2}}} \right)$。
上述滴定时,可采用 作指示剂,滴定终点的现象为 。
淀粉溶液;当滴入最后半滴标准液后,溶液由蓝色变为无色,且半分钟内颜色不复原
"]]根据淀粉遇到碘变蓝,上述滴定时,可采用淀粉溶液作指示剂,滴定终点的现象为当滴入最后半滴标准液后,溶液由蓝色变为无色,且半分钟内颜色不复原。
同学乙认为该甲设计方案不合理,原因是甲测得的${c}\left( {{\text{I}}_{\text{2}}} \right)$实际为平衡体系中 的物质的量浓度之和$\rm ($填化学式$\rm )$。
${{\\text{I}}_{2}}$、$\\text{I}_{3}^{-}$
"]]结合化学平衡移动原理,碘消耗后,平衡逆向移动,原因是甲测得的${c}\left( {{\text{I}}_{\text{2}}} \right)$实际为平衡体系中${{\text{I}}_{\text{2}}}$、$\text{I}_{3}^{-}$的物质的量浓度之和。
Ⅱ.乙对上述方案进行改进,室温下测定水溶液中该反应平衡常数的过程如下$\rm ($溶液体积变化忽略不计$\rm )$:
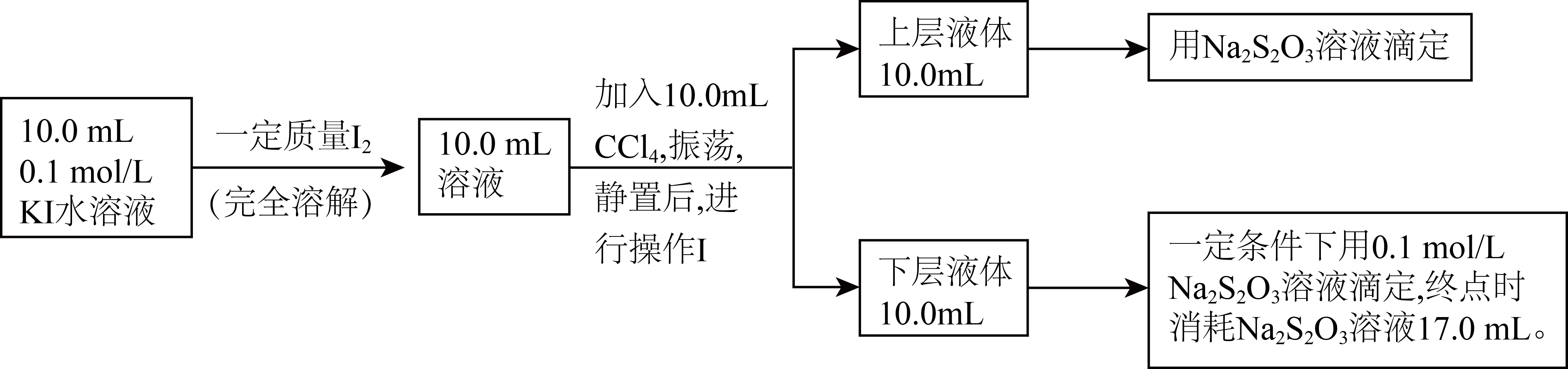
已知:$\mathrm{I}^{-}$和$\text{I}_{3}^{-}$不溶于$\text{CC}{{\text{l}}_{4}}$;室温下,碘单质在四氯化碳和水混合液体中的浓度比值即$\dfrac{{c}\left[ {{\text{I}}_{\text{2}}}\left( \text{CC}{{\text{l}}_{\text{4}}} \right) \right]}{{c}\left[ {{\text{I}}_{\text{2}}}\left( {{\text{H}}_{\text{2}}}\text{O} \right) \right]}$是常数$\rm ($用$K_\rm d$表示,称为分配系数$\rm )$,室温条件下$K_\rm d=85$。
操作Ⅰ的名称为 。
分液
"]]$\rm KI$溶液和碘反应后,用$\rm CCl_{4}$萃取,$\rm CCl_{4}$密度大于水,在下层,萃取后的水溶液用${c\;\rm mol}\cdot {{\text{L}}^{{-1}}}$的$\text{N}{{\text{a}}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{3}}}$溶液进行滴定,下层的$\rm CCl_{4}$在一定条件下用$ {c\;\rm mol}\cdot {{\text{L}}^{{-1}}}$的$\text{N}{{\text{a}}_{\text{2}}}{{\text{S}}_{\text{2}}}{{\text{O}}_{\text{3}}}$溶液进行滴定然后计算;结合分析,操作$\rm I$的名称为萃取。
若分别用$\left[ {{\text{I}}^{-}} \right]$、$\left[ \text{I}_{3}^{-} \right]$、${{\left[ {{\text{I}}_{2}} \right]}_{ {a}}}$表示上层液体中:$\mathrm{I}^{-}$、$\text{I}_{3}^{-}$、${{\text{I}}_{2}}$的物质的量浓度,用${{\left[ {{\text{I}}_{2}} \right]}_{ {b}}}$表示下层液体中${{\text{I}}_{2}}$的物质的量浓度,则反应${{\text{I}}_{2}}+{{\text{I}}^{-}}\rightleftharpoons \text{I}_{3}^{-}$的平衡常数$ K$的表达式为 ,上层液体中${{\left[ {{\text{I}}_{\text{2}}} \right]}_{ {a}}}=$ 。
$\\dfrac{{c}\\left( \\text{I}_{\\text{3}}^{{-}} \\right)}{{c}{{\\left( {{\\text{I}}_{\\text{2}}} \\right)}_{ {a}}}\\cdot {c}\\left( {{\\text{I}}^{{-}}} \\right)}$;$\\rm 0.001$
"]]若分别用$\left[ {{\text{I}}^{-}} \right]$、$\left[ \text{I}_{3}^{-} \right]$、${{\left[ {{\text{I}}_{2}} \right]}_{a}}$表示上层液体中$\mathrm{I}^{-}$、$\text{I}_{3}^{-}$和${{\text{I}}_{2}}$的物质的量浓度,用${{\left[ {{\text{I}}_{2}} \right]}_{b}}$表示下层液体中${{\text{I}}_{2}}$的物质的量浓度,则反应${{\text{I}}_{\text{2}}}+{{\text{I}}^{{-}}}\rightleftharpoons \text{I}_{\text{3}}^{{-}}$的平衡常数$K$的表达式为 $\dfrac{{c}\left( \text{I}_{\text{3}}^{{-}} \right)}{{c}{{\left( {{\text{I}}_{\text{2}}} \right)}_{ {a}}}\cdot {c}\left( {{\text{I}}^{{-}}} \right)}$;依据化学反应可知,设碘单质物质的量为$x$,$\rm I_{2}+2Na_{2}S_{2}O_{3}=2NaI+Na_{2}S_{4}O_{6}$,则$ {x= 0}{.1\;\rm mol/L}\times {0}{.017\;\rm L}\times \dfrac{{1}}{{2}}{=0}{.00085\;\rm mol}$,浓度$\rm =\dfrac{{0}{.00085\;\rm mol}}{{0}{.010\;\rm L}}\rm =0.085\;\rm mol/L$,依据$\dfrac{{c}\left[ \rm {{{I}}_{{2}}}\left(\rm {CC}{{{l}}_{{4}}} \right) \right]}{{c}\left[ \rm {{{I}}_{{2}}}\left( {{{H}}_{{2}}}{O} \right) \right]}\rm =85$,$\dfrac{{0}{.085}}{{c}\left[\rm {{{I}}_{{2}}}{(}{{{H}}_{{2}}}{O)} \right]}\rm =85$,上层液体中${{\left[ \rm {{{I}}_{2}} \right]}_{a}}=\rm 0.001\rm \;{mol}\cdot {{{L}}^{{-1}}}$。
实验测得上层溶液的${c}\left( \text{I}_{\text{3}}^{{-}} \right) =0 {.05\;\rm mol}\cdot {{\text{L}}^{{-1}}}$,结合上述有关数据,计算出该反应的平衡常数$K=$ 。
$1000$
"]]依据$\dfrac{{c}\left[ {{\text{I}}_{\text{2}}}\text{CC}{{\text{l}}_{\text{4}}} \right]}{{c}\left[ {{\text{I}}_{\text{2}}}{{\text{H}}_{\text{2}}}\text{O} \right]}\rm =85$,则水溶液中碘单质的浓度$c\rm (I_{2})=0.001\;\rm mol/L$;$10\;\rm ml$溶液中$c(\text{I}_{\text{3}}^{{-}}\rm )=0.05\;\rm mol\cdot L^{-1}$,物质的量$\rm 0.0005\;\rm mol$,所以反应的碘离子物质的量为$\rm 0.0005\;\rm mol$,平衡状态碘离子物质的量$\rm =0.1\;\rm mol/L\times 0.01\;\rm L-0.0005\;\rm mol=0.0005\;\rm mol$,浓度$ c\rm (I^{-})=0.05\;\rm mol/L$,$\rm I_{2}+I^{-}⇌\text{I}_{\text{3}}^{{-}}$;平衡常数$ K=\dfrac{{c}\left( {\text{I}}_{\text{3}} ^{{-}} \right)}{{c}\left( {{\text{I}}^{{-}}} \right){c}\left( {{\text{I}}_{\text{2}}} \right)}\rm =\dfrac{\text{0} {.05\;\rm mol/L}}{\text{0} {.001\;\rm mol/L}\times \text{0} {.05\;\rm mol/L}}\rm =1000\;\rm L/mol$。
高中 | 化学平衡常数题目答案及解析(完整版)
