高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
甲醇是重要的化工原料,应用前景广阔。工业上一般采用以下方法合成:
反应Ⅰ:$\text{CO}(\text{g})+2{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}(\text{g})\quad \Delta H=-90\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
反应Ⅱ:$\text{C}{{\text{O}}_{2}}(\text{g})+{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{CO}(\text{g})+{{\text{H}}_{2}}\text{O}(\text{g})\quad \Delta H=+41\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
则反应Ⅲ:$\text{C}{{\text{O}}_{2}}(\text{g})+3{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}(\text{g})+{{\text{H}}_{2}}\text{O}(\text{g})$的$\Delta H=$ $\text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$
$\\rm -49$
"]]由盖斯定律可知,由反应Ⅰ$\rm +$反应Ⅱ可得该反应Ⅲ,则$\text{C}{{\text{O}}_{2}}(\text{g})+3{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{C}{{\text{H}}_{3}}\text{OH}(\text{g})+{{\text{H}}_{2}}\text{O}(\text{g})$的$\Delta H=\left( -90\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}} \right)+\left( +41\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}} \right)=-49\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
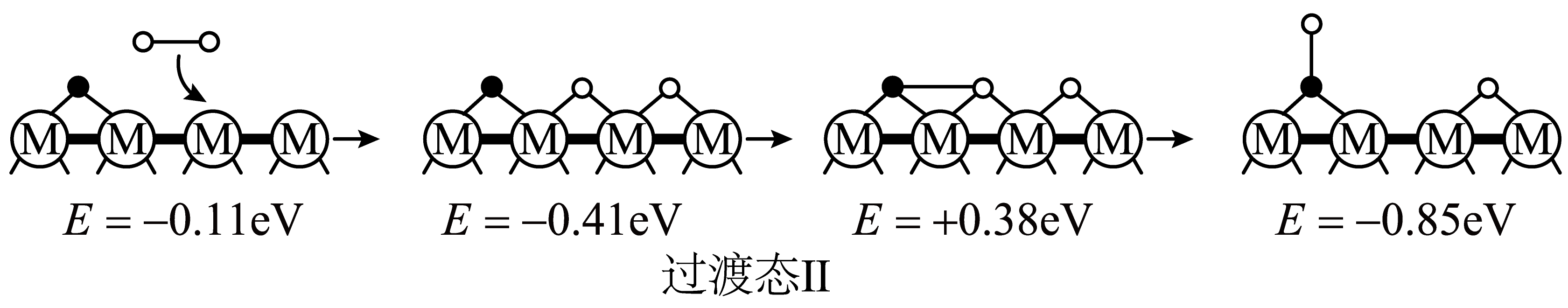
在催化剂$\rm M$的作用下,反应Ⅱ的微观反应历程和相对能量$\rm (E)$如下表所示,其中吸附在催化剂表面上的物种用“*”标注。已知;$\rm ●$表示$\rm C$,$\rm ·$表示$\rm O$,$\rm ○$表示$\rm H$。
| 历程 | 反应 |
历程$\rm a$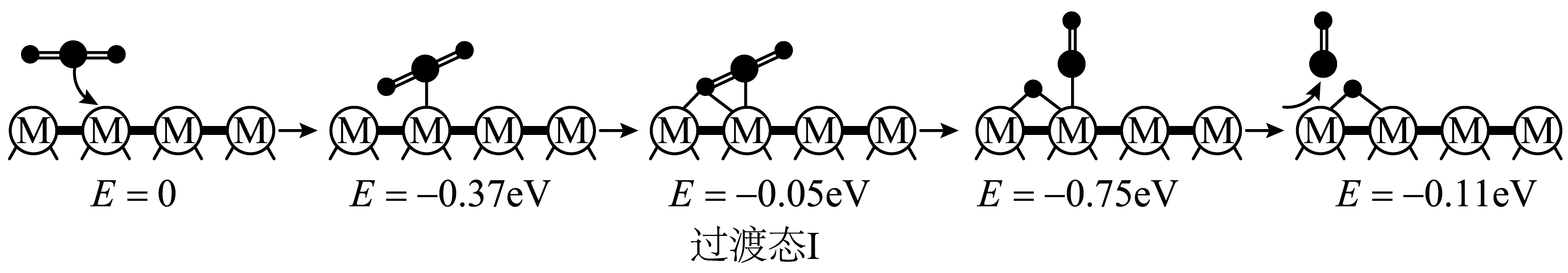 | $\text{C}{{\text{O}}_{2}}(\text{g})\rightleftharpoons \text{CO}(\text{g})+\text{O*}$ |
历程b
| ${{\text{H}}_{2}}(\text{g})+\text{O*}\rightleftharpoons \text{HO*}+\text{H*}$ |
历程$\rm c$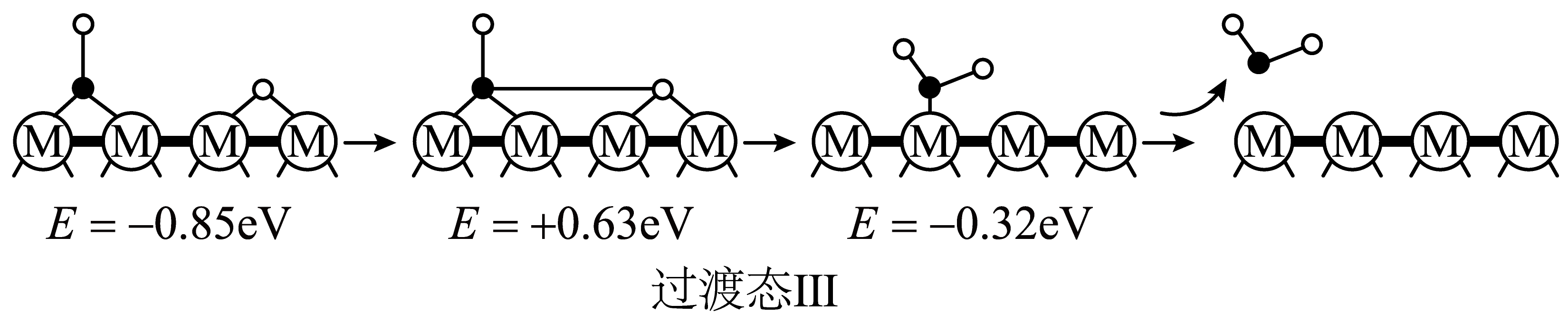 |
①历程$\rm c$对应的反应 。
②决定反应Ⅱ总反应速率的是历程 $\rm ($填“$\rm a$”、“$\rm b$”或“$\rm c$”$\rm )$。
$\\text{HO*+H*}\\rightleftharpoons {{\\text{H}}_{\\text{2}}}\\text{O(g)}$ ; $\\rm c$
"]]①反应Ⅱ为$\text{C}{{\text{O}}_{2}}(\text{g})+{{\text{H}}_{2}}(\text{g})\rightleftharpoons \text{CO}(\text{g})+{{\text{H}}_{2}}\text{O}(\text{g})$,总历程为反应Ⅱ,结合历程$\rm a$、$\rm b$可知,历程$\rm c$对应的反应$\text{HO*+H*}\rightleftharpoons {{\text{H}}_{\text{2}}}\text{O(g)}$。
②活化能越小反应越快,活化能越大反应越慢,决定总反应速率的是慢反应;据图可知决定反应Ⅱ总反应速率的是历程$\rm c$;
将$\text{C}{{\text{O}}_{2}}$和${{\text{H}}_{2}}$按物质的量之比$\rm 1:3$充入一恒容密闭容器中
①若只发生反应Ⅲ,下列叙述能说明该反应达到平衡状态的是 。
$\rm A$.$\rm \text{C}{{\text{O}}_{2}}$和$\rm {{\text{H}}_{2}}$的转化率相等
$\rm B$.生成$\rm 3$ $\rm mol$ $\rm O-H$键的同时生成$\rm 3$ $\rm mol\ H-H$键
$\rm C$.$\Delta H-T\Delta S=0$时
$\rm D$.混合气体的密度保持不变
②若同时发生反应Ⅱ和反应Ⅲ,测得$\text{C}{{\text{O}}_{2}}$的平衡转化率随温度、压强变化的情况如图所示。
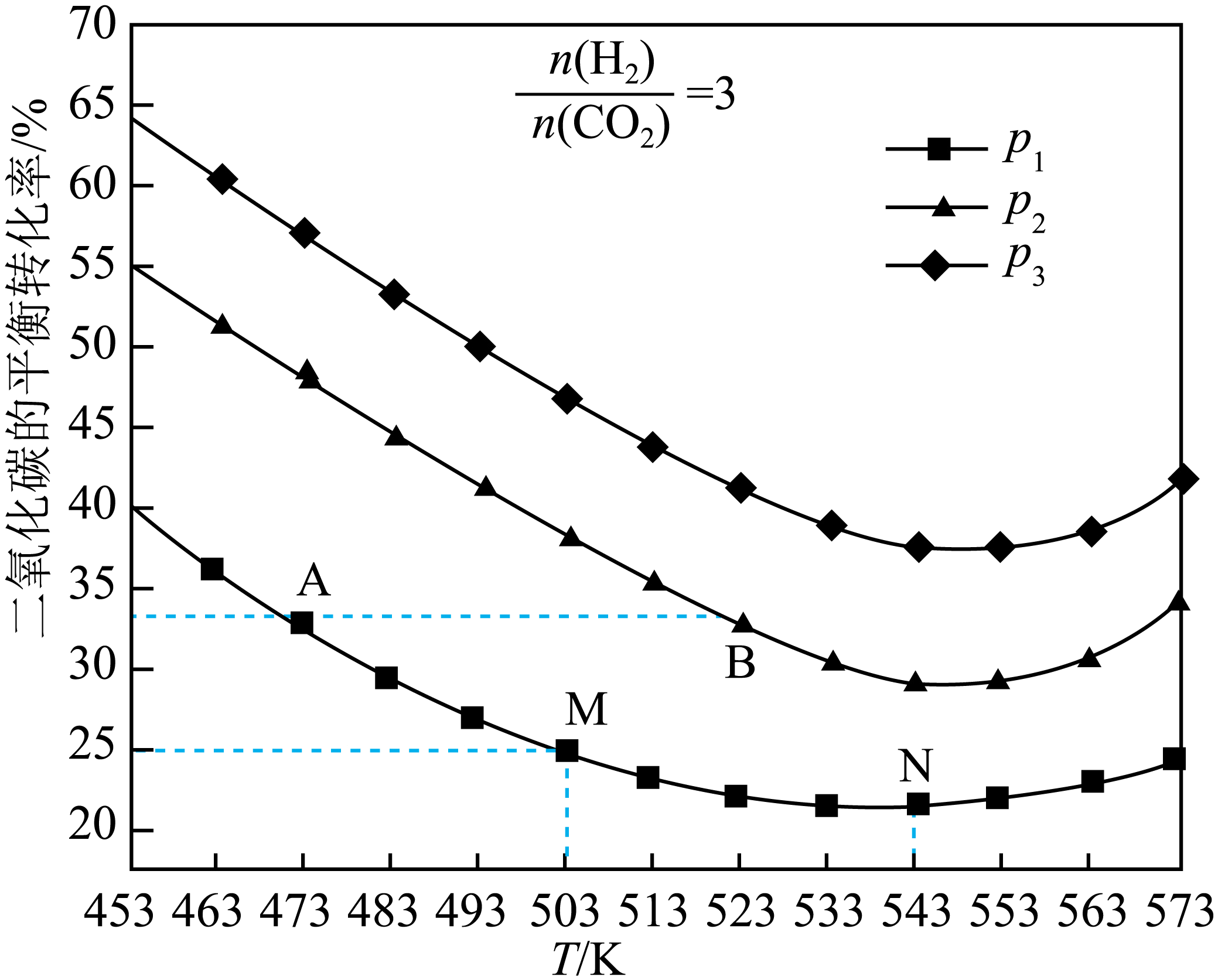
$\rm i.$压强${{p}_{1}}$、${{p}_{2}}$、${{p}_{3}}$的大小关系为 。
$\rm ii.A$点、$\rm B$点的化学反应速率大小:$v\left( \text{A} \right)$ $v\left( \text{B} \right)\rm ($填“$\rm \lt $”、“$\rm =$”或“$\rm \gt $”$\rm )$。
③图中$\rm M$点对应的温度下,已知$\rm CO$的选择性$\rm ($生成的$\rm CO$与转化的$\text{C}{{\text{O}}_{2}}$的百分比$\rm )$为$\rm 50$%,该温度下反应Ⅱ的平衡常数为 $\rm ($结果保留$\rm 3$位小数$\rm )$。
$\\rm B$ ; ${{p}_{1}} \\lt {{p}_{2}} \\lt {{p}_{3}}$ ; $\\rm \\lt $ ; $0.017$
"]]①$\rm A$.$\rm \text{C}{{\text{O}}_{2}}$和$\rm {{\text{H}}_{2}}$的投料比等于反应系数比,则$\rm \text{C}{{\text{O}}_{2}}$和$\rm {{\text{H}}_{2}}$的转化率一直相等,不能说明反应达到平衡状态;
$\rm B$.生成$\rm 3$ $\rm mol$ $\rm O-H$键的同时生成$\rm 3$ $\rm mol$ $\rm H-H$键,说明正逆反应速率相等,反应达到平衡;
$\rm C$.$\Delta H-T\Delta S=0$,不能说明正逆反应速率相等,不确定反应达到平衡状态;
$\rm D$.容器体积和气体总质量始终不变,则混合气体的密度始终不变,因此不能说明反应已达平衡;
故选:$\rm B$;
②$\rm i.$反应Ⅱ为反应前后气体物质的量不变的反应,加压平衡不移动,而对于反应Ⅲ,加压平衡正向移动,使得二氧化碳的平衡转化率增大,故${{p}_{1}}\lt {{p}_{2}} \lt {{p}_{3}}$;
$\rm ii.B$点温度更高,压强更大,故化学反应速率更大,$v\left( \text{A} \right) \lt v\left( \text{B} \right)$;
③假设氢气、二氧化碳投料分别为$\rm 3\;\rm mol$、$\rm 1\;\rm mol$,图中$\rm M$点对应的温度下,二氧化碳转化率为$\rm 25\%$,则反应$\rm 0.25\;\rm mol$二氧化碳,已知$\rm CO$的选择性$\rm ($生成的$\rm CO$与转化的$\text{C}{{\text{O}}_{2}}$的百分比$\rm )$为$\rm 50\%$,则生成$\rm CO$为$\rm 0.125\;\rm mol$;
$\begin{matrix} {} \\起始 \left( \text{mol} \right) \\ 转化\left( \text{mol} \right) \\平衡 \left( \text{mol} \right) \\ \end{matrix}\begin{matrix} \text{C}{{\text{O}}_{\text{2}}}\text{(g)} \\ {} \\ \text{0}\text{.125} \\ {} \\ \end{matrix}\begin{matrix} + \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} {{\text{H}}_{\text{2}}}\text{(g)} \\ {} \\ \text{0}\text{.125} \\ {} \\ \end{matrix}\begin{matrix} \rightleftharpoons \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} \text{CO(g)} \\ \text{0} \\ \text{0}\text{.125} \\ {} \\ \end{matrix}\begin{matrix} + \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} {{\text{H}}_{\text{2}}}\text{O(g)} \\ \text{0} \\ \text{0}\text{.125} \\ {} \\ \end{matrix}$
$\begin{matrix} {} \\起始 \left( \text{mol} \right) \\ 转化\left( \text{mol} \right) \\平衡 \left( \text{mol} \right) \\ \end{matrix}\begin{matrix} \text{C}{{\text{O}}_{\text{2}}}\text{(g)} \\ \text{1} \\ \text{0}\text{.25-0}\text{.125=0}\text{.125} \\ {} \\ \end{matrix}\begin{matrix} + \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} \text{3}{{\text{H}}_{\text{2}}}\text{(g)} \\ \text{3} \\ 0.375 \\ {} \\ \end{matrix}\begin{matrix} \rightleftharpoons \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} \text{C}{{\text{H}}_{\text{3}}}\text{OH(g)} \\ \text{0} \\ \text{0}\text{.125} \\ {} \\ \end{matrix}\begin{matrix} + \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} {{\text{H}}_{\text{2}}}\text{O(g)} \\ \text{0} \\ \text{0}\text{.125} \\ {} \\ \end{matrix}$
则平衡时二氧化碳、氢气、一氧化碳、水的物质的量分别为$\rm 0.75\;\rm mol$、$\rm 2.5\;\rm mol$、$\rm 0.125\;\rm mol$、$\rm 0.25\;\rm mol$,反应Ⅱ为等分子数的反应,则该温度下反应Ⅱ的平衡常数为$\dfrac{0.25\times 0.125}{2.5\times 0.75}=0.017$。
高中 | 化学平衡常数题目答案及解析(完整版)