高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
在某催化剂作用下$\rm C{{O}_{2}}$和$\rm {{H}_{2}}$合成甲醇涉及以下反应:
I.${\rm C{{O}_{2}}(g)+3{{H}_{2}}(g)\rightleftharpoons C{{H}_{3}}OH(g)+{{H}_{2}}O(g)}\quad\Delta{{H}_{1}}$
II.${\rm C{{O}_{2}}(g)+{{H}_{2}}(g)\rightleftharpoons CO(g)+{{H}_{2}}O(g)}\quad\Delta {{H}_{2}}=+41.3\rm \ kJ\cdot mo{{l}^{-1}}$
在恒容密闭容器中,$\rm C{{O}_{2}}(g)$和$\rm {{H}_{2}}(g)$分别投$\rm 0.8\ mol\cdot {{L}^{-1}}$、$\rm 1.56\ mol\cdot {{L}^{-1}}$发生反应,平衡时$\rm C{{O}_{2}}$的转化率及$\rm C{{H}_{3}}OH$和$\rm CO$的选择性$([\dfrac{{{n}_{{生成}}}{\rm (C{{H}_{3}}OH)}{或}{{n}_{{生成}}}\rm (CO)}{{{n}_{{总转化}}}\rm (C{{O}_{2}})}\times 100\%]$随温度变化如图所示。下列说法正确的是$\rm (\qquad)$
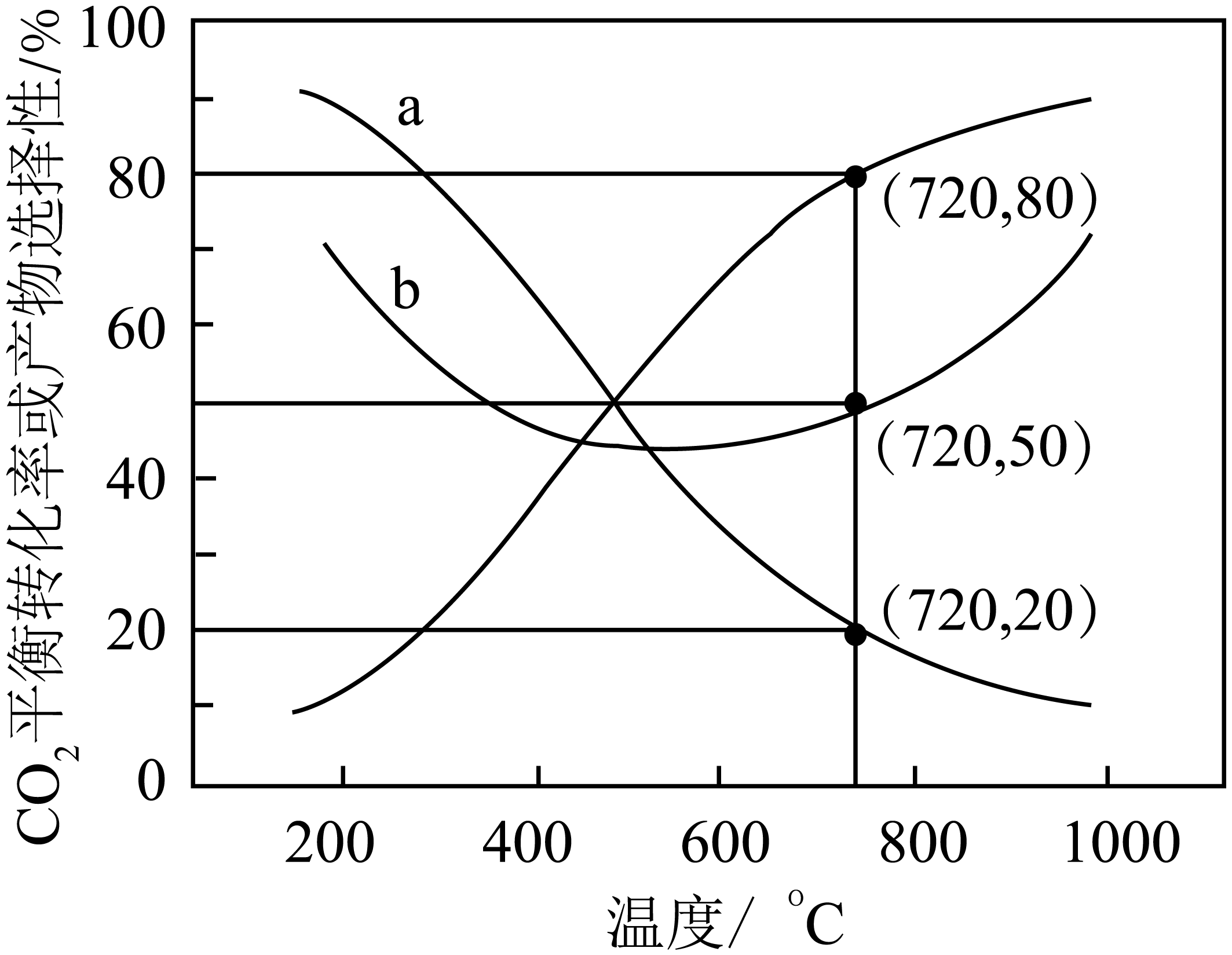
同时提高$\\rm C{{O}_{2}}$的平衡转化率和平衡时$\\rm C{{H}_{3}}OH$的选择性应选择在高温条件下反应
","$\\rm 600\\ ^\\circ \\text{C}$后,升高温度对反应$\\rm I$的影响程度大于反应$\\rm II$
","开发低温时的高效催化剂,可以提高$\\rm C{{O}_{2}}$的平衡转化率
","$\\rm 720\\ ^\\circ \\text{C}$时,反应$\\rm I$的平衡常数$K=0.08$
"]根据反应$\rm I$和$\rm II$可知,其反应$\rm II$的产物是$\rm CO$,且$\Delta{{H}_{2}}\gt 0$,也就是说,温度升高该平衡都正向移动,从而使$\rm CH_{3}OH$的产量变少,$\rm CO$含量增加,故曲线$\rm c$代表$\rm CO$的选择性,$\rm a$曲线表示$\rm CH_{3}OH$的选择性,同时说明$\Delta{{H}_{1}}\lt 0$,曲线$\rm b$表示平衡时二氧化碳的转化率。
$\rm A$.$\rm a$曲线表示$\rm CH_{3}OH$的选择性,$\Delta{{H}_{1}}\lt 0$,甲醇的选择性应该在低温条件下且二氧化碳的平衡转化率先随温度升高降低后再升高,故$\rm A$错误。
$\rm B$.$\rm 600\ ^\circ \text{C}$后,升高温度对反应$\rm I$的影响程度小于反应$\rm II$,故$\rm B$错误。
$\rm C$.催化剂不影响平衡的移动,不可以提高$\rm C{{O}_{2}}$的平衡转化率,故$\rm C$错误。
$\rm D$.$\rm 720\ ^\circ \text{C}$时,反应$\rm I$的甲醇选择性是$\rm 20\%$,选择$\rm II$一氧化碳的选择性$\rm 80\%$,二氧化碳的平衡转化率为$\rm 50\%$;$\rm \begin{matrix} {} & \rm C{{O}_{2}}(g) & + & \rm {{H}_{2}}(g) & \rightleftharpoons & \rm CO(g) & + & \rm {{H}_{2}}O(g) \\ 转化\rm (mol/L) & 0.8\times 50\%\times 80\% & {} & 0.8\times 50\%\times 80\% & {} & 0.8\times 50\%\times 80\% & {} & 0.8\times 50\%\times 80\% \\ \end{matrix}$
$\begin{matrix} {} & \rm C{{O}_{2}}(g) & +\rm 3{{H}_{2}}(g) & \rightleftharpoons \rm C{{H}_{3}}OH(g) & \rm +{{H}_{2}}O(g) \\ 起始\rm (mol/L) & 0.8 & 1.56 & 0 & 0 \\ 转化\rm (mol/L) & 0.8\times 50 \%\times 20 \% & 3(0.8\times 50 \%\times 20 \% ) & 0.8\times 50 \%\times 20 \% & 0.8\times 50 \%\times 20 \% \\ 平衡\rm (mol/L) & 0.8\times 50\% & 1.56-3(0.8\times 50 \%\times 20 \% )-0.8\times 50 \%\times 80 \% & 0.8\times 50 \%\times 20 \% & 0.8\times 50 \%\times 20 \%+0.8\times 50 \%\times 80 \% \\ \end{matrix}$
$K=\dfrac{c{\rm (C{{H}_{3}}OH)}c{\rm ({{H}_{2}}O)}}{c{\rm (C{{O}_{2}})}{{c}^{3}}({{\rm H}_{2}})}=\dfrac{0.8\times 50\%\times 20\%\times 0.8\times 50\%}{0.8\times 50\%\times {{[1.56-0.32-0.24]}^{3}}}=0.08$,故$\rm D$正确。
故选:$\rm D$
高中 | 化学平衡常数题目答案及解析(完整版)
