高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
利用$\rm C{{O}_{2}}$、$\rm {{H}_{2}}$为原料合成$\rm C{{H}_{3}}OH$的主要反应如下。
Ⅰ.${\rm C{{O}_{2}}(g)+3{{H}_{2}}(g)\rightleftharpoons C{{H}_{3}}OH(g)+{{H}_{2}}O(g)}\quad\Delta{{H}_{1}}=-48.5\ {\rm kJ\cdot mo{{l}^{-1}}}\quad{{K}_{1}}$
Ⅱ.${\rm C{{O}_{2}}(g)+{{H}_{2}}(g)\rightleftharpoons CO(g)+{{H}_{2}}O(g)}\quad\Delta{{H}_{2}}=+43.9{\rm \ kJ \cdot mo{{l}^{-1}}}\quad{{K}_{2}}$
回答下列问题:
已知反应Ⅲ的平衡常数${{K}_{3}}=\dfrac{{{K}_{1}}}{{{K}_{2}}}$,写出反应Ⅲ的热化学方程式 。
${\\rm CO(g)+2H_{2}(g)\\rightleftharpoons CH_{3}OH(g)}\\quad\\Delta H=-92.4\\rm \\ kJ/mol$
"]]已知反应Ⅲ的平衡常数${{K}_{3}}=\dfrac{{{K}_{1}}}{{{K}_{2}}}$,由盖斯定律可知反应Ⅰ$-$反应Ⅱ可得反应Ⅲ的热化学方程式为:${\rm CO(g)+2H_{2}(g)\rightleftharpoons CH_{3}OH(g)}\quad\Delta{{H}_{3}}= \Delta{{H}_{1}}- \Delta{{H}_{2}}=-48.5\rm \ kJ\cdot mol^{-1}-43.9\ kJ\cdot mo{{l}^{-1}}=-92.4\ kJ\cdot mo{{l}^{-1}}$。
一定条件下,向恒压密闭容器中以一定流速通入$\rm C{{O}_{2}}$和$\rm {{H}_{2}}$混合气体,$\rm C{{O}_{2}}$平衡转化率和$\rm C{{H}_{3}}OH$选择性$\left[ \dfrac{n\rm (生成的C{{H}_{3}}OH)}{n{\rm (消耗的\rm C{{O}_{2}})}}\times 100 \% \right]$随温度、投料比的变化曲线如图所示。
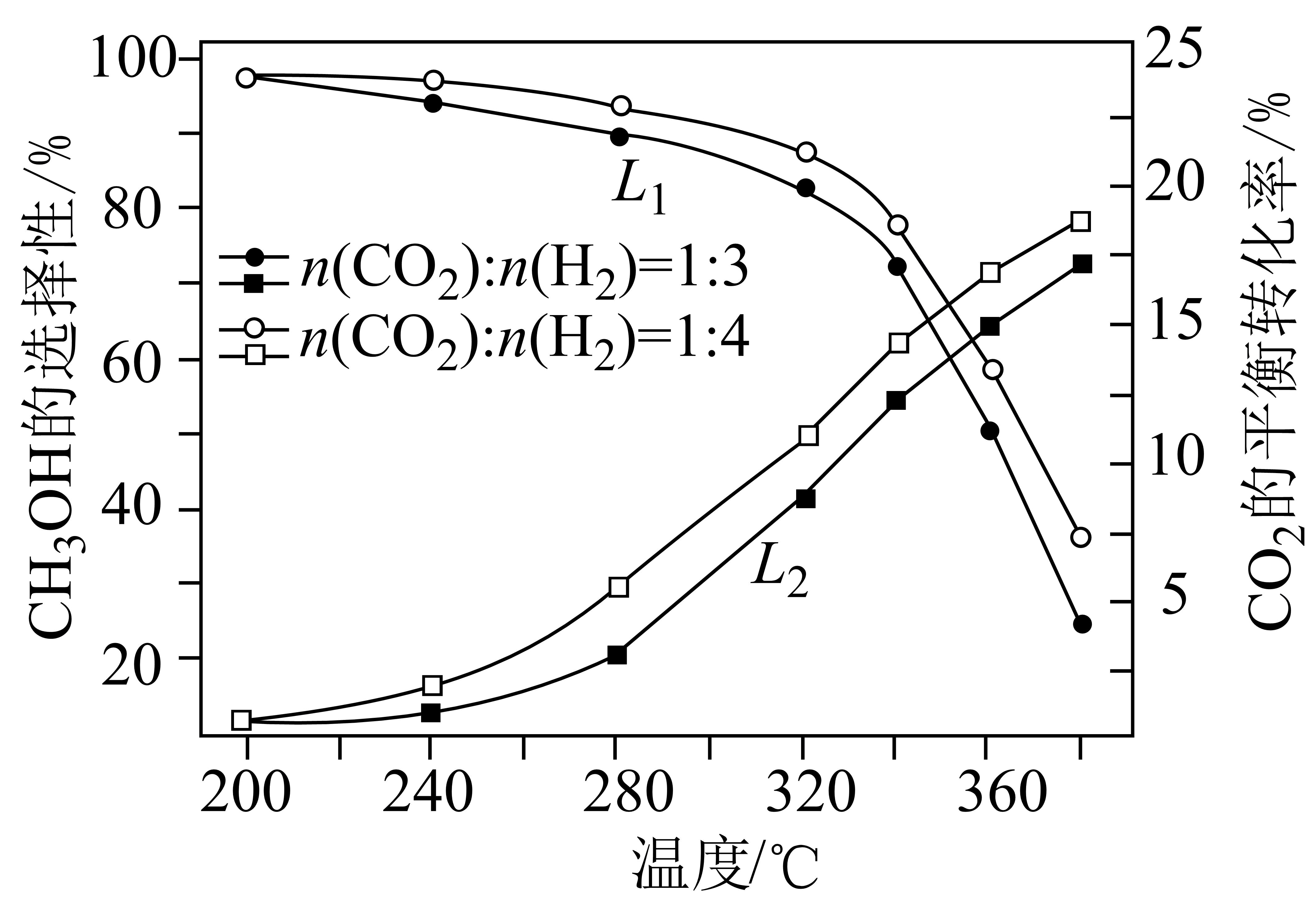
①表示$\rm C{{H}_{3}}OH$选择性的曲线是 (填“${{L}_{1}}$”或“${{L}_{2}}$”),$\rm C{{O}_{2}}$平衡转化率随温度升高发生如图变化的原因是 。
②生成$\rm C{{H}_{3}}OH$的最佳条件是 (填标号)。
a.$\rm 220\ ^\circ \text{C}$,$n{\rm (C{{O}_{2}})}:n{\rm ({{H}_{2}})}=1:3$
b.$\rm 220\ ^\circ \text{C}$,$n{\rm (C{{O}_{2}})}:n{\rm ({{H}_{2}})}=1:4$
c.$\rm 320\ ^\circ \text{C}$,$n{\rm (C{{O}_{2}})}:n{\rm ({{H}_{2}})}=1:4$
d.$\rm 320\ ^\circ \text{C}$,$n{\rm (C{{O}_{2}})}:n{\rm ({{H}_{2}})}=1:3$
$L_{1}$;反应Ⅱ是吸热反应,升高温度,反应Ⅱ正向移动的程度大于反应Ⅰ逆向移动的程度,$\\rm CO_{2}$平衡转化率随温度的升高而增大;c
"]]①反应Ⅰ是放热反应,升高温度,平衡逆向移动,$\rm CH_{3}OH$的转化率减小,选择性减小,则表示$\rm CH_{3}OH$选择性的曲线是$L_{1}$,$L_{2}$代表$\rm CO_{2}$平衡转化率随温度变化的曲线,反应Ⅱ是吸热反应,升高温度,反应Ⅱ正向移动的程度大于反应Ⅰ逆向移动的程度,$\rm CO_{2}$平衡转化率随温度的升高而增大。
②由图可知,$\rm 320\ ^\circ \text{C}$,$n{\rm (C{{O}_{2}})}:n{\rm ({{H}_{2}})}=1:4$时,$\rm CH_{3}OH$选择性较大,同时$\rm CO_{2}$的转化率也较大,故选c。
一定温度下,向压强恒为$p\ \rm MPa$的密闭容器中通入$\rm 1\ mol \ C{{O}_{2}}(g)$和$\rm 3\ mol \ {{H}_{2}}(g)$,充分反应后,测得$\rm C{{O}_{2}}$平衡转化率为$a$,$\rm C{{H}_{3}}OH$选择性为$b$,该温度下反应Ⅱ的平衡常数$K_{\rm p}= $
$\\dfrac{a(a-ab)}{(1-a)(3-a-2ab)}$
"]]根据已知条件列出“三段式”
$\rm \begin{matrix} {} \\ 起始\rm (mol) \\ 转化\rm (mol) \\ 平衡\rm (mol) \\ \end{matrix}\begin{matrix} \rm C{{O}_{2}}(g) & + & \rm 3{{H}_{2}}(g) & \rightleftharpoons & \rm C{{H}_{3}}OH(g) & + & \rm {{H}_{2}}O(g) \\ 1 & {} & 3 & {} & 0 & {} & 0 \\ x & {} & 3x & {} & x & {} & x \\ 1-x & {} & 3-3x & {} & x & {} & x \\ \end{matrix}$
$\begin{matrix} {} \\ 起始\rm (mol) \\ 转化\rm (mol) \\ 平衡\rm (mol) \\ \end{matrix}\begin{matrix} \rm C{{O}_{2}}(g) & + & \rm {{H}_{2}}(g) & \rightleftharpoons & \rm CO(g) & + & \rm {{H}_{2}}O(g) \\ 1-x & {} & 3-3x & {} & 0 & {} & x \\ y & {} & y & {} & y & {} & y \\ 1-x-y & {} & 3-3x-y & {} & y & {} & x+y \\ \end{matrix}$
充分反应后,测得$\rm C{{O}_{2}}$平衡转化率为$\dfrac{x+y}{1}=a$,$\rm C{{H}_{3}}OH$选择性为$\dfrac{x}{x+y}=b$,解得$x=ab\ \rm mol$,$y=(a-ab)\ \rm mol$,平衡时$n{\rm (C{{O}_{2}})}=(1-a)\ \rm mol$,$n{\rm (H_{2})}=(3-a-2ab)\ \rm mol$,$n{\rm (CO)}=(a-ab)\ \rm mol$,$n{\rm (H_{2}O)}=a\ \rm mol$,$n{\rm (CH_{3}OH)}=ab\ \rm mol$,则该温度下反应Ⅰ的平衡常数$K_{\rm p}=\dfrac{\dfrac{a}{4-2ab}p\times \dfrac{a-ab}{4-2ab}p}{\dfrac{1-a}{4-2ab}p\times \dfrac{3-a-2ab}{4-2ab}p}=\dfrac{a(a-ab)}{(1-a)(3-a-2ab)}$。
向压强恒为$\rm 3.0\ MPa$的密闭容器中通入反应混合气$\left[ \dfrac{V\rm (C{{O}_{2}})}{V\rm ({{H}_{2}})}=\dfrac{1}{2} \right]$,在$\rm 1\ mol \ NiGa$催化作用下只发生反应Ⅰ,测得$\rm C{{H}_{3}}OH$时空收率(表示单位物质的量催化剂表面甲醇的平均生成速率)随温度的变化曲线如图所示。
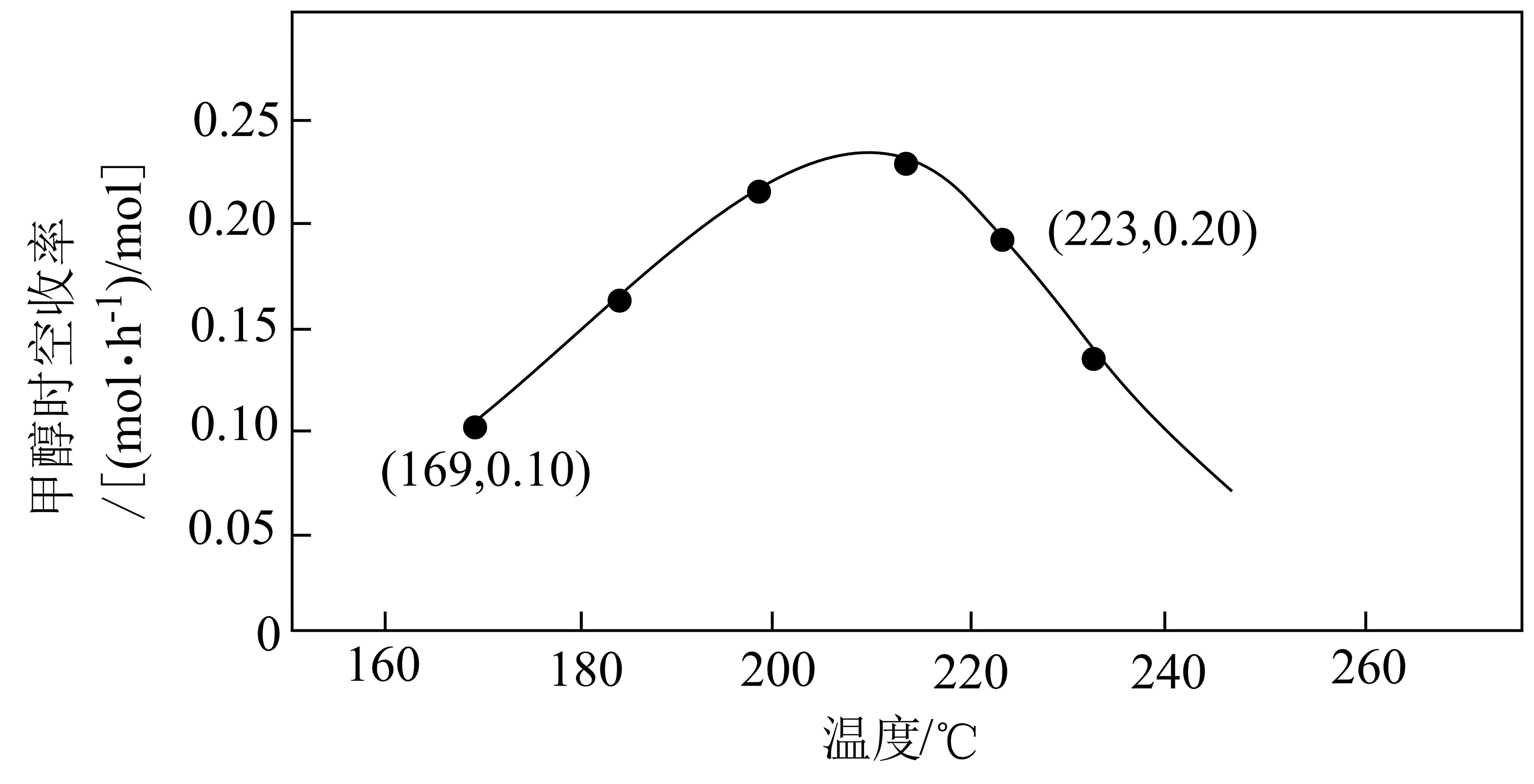
①$\rm C{{H}_{3}}OH$时空收率随温度升高先增大后减小的原因是 。
②$\rm 223\ ^\circ C$时,$\rm {{H}_{2}}$的平均反应速率$v\rm ({{H}_{2}})=$ $\rm mol\cdot {{h}^{-1}}$。
温度较低时,反应速率较慢,反应未达到平衡,升高温度,反应速率加快,$\\rm CH_{3}OH$时空收率增大,当温度较高,反应速率较快,反应达到平衡,升高温度,平衡逆向移动,$\\rm CH_{3}OH$的转化率减小,$\\rm CH_{3}OH$时空收率减小;$\\rm 0.6\\ mol\\cdot h^{-1}/mol$
"]]①$\rm C{{H}_{3}}OH$时空收率随温度升高先增大后减小的原因是:温度较低时,反应速率较慢,反应未达到平衡,升高温度,反应速率加快,$\rm CH_{3}OH$时空收率增大,当温度较高,反应速率较快,反应达到平衡,升高温度,平衡逆向移动,$\rm CH_{3}OH$的转化率减小,$\rm CH_{3}OH$时空收率减小。
②$\rm 223\ ^\circ C$时,$\rm C{{H}_{3}}OH$时空收率为$\rm 0.2\ [(mol\cdot h^{-1})/mol]$,$\rm {{H}_{2}}$的平均反应速率$v\rm \left({H}_{2}\right)=0.2\ [(mol\cdot h^{-1})/mol]\times 1\ mol\times 3=0.6\ [(mol\cdot h^{-1})/mol]$。
高中 | 化学平衡常数题目答案及解析(完整版)
