高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
为减少$\rm C{{O}_{2}}$对环境造成的影响,可采用“$\rm C{{O}_{2}}$催化加氢制甲醇”方法将其资源化利用。该反应体系中涉及以下三个反应:
Ⅰ.${\rm C{{O}_{2}}(g)+3{{H}_{2}}(g)\rightleftharpoons C{{H}_{3}}OH(g)+{{H}_{2}}O(g)}\quad\Delta {{H}_{1}}=a\rm \ kJ\cdot mo{{l}^{-1}}$
Ⅱ.${\rm C{{O}_{2}}(g)+{{H}_{2}}(g)\rightleftharpoons CO(g)+{{H}_{2}}O(g)}\quad\Delta {{H}_{2}}=b\rm \ kJ\cdot mo{{l}^{-1}}$
Ⅲ.$\rm CO(g)+2{{H}_{2}}(g)\rightleftharpoons C{{H}_{3}}OH(g)$
反应Ⅰ、Ⅱ的$\lg K(K$代表化学平衡常数$\rm )$随$1/T($温度的倒数$\rm )$的变化如图所示。
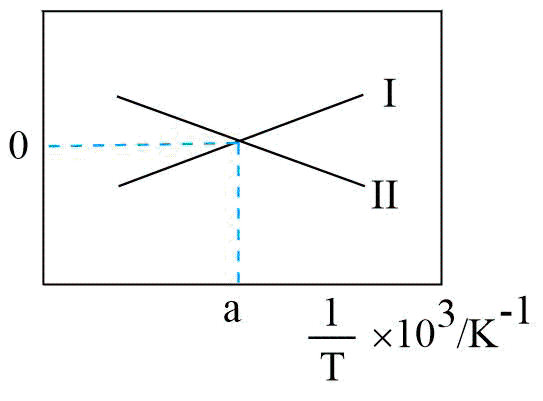
①降低温度,反应$\rm CO(g)+2{{H}_{2}}(g)\rightleftharpoons C{{H}_{3}}OH(g)$的化学平衡常数 $\rm ($填“增大”或“减小”或“不变”$\rm )$。原因为 。
②关于反应Ⅲ的$\lg K(K$代表化学平衡常数$\rm )$随$1/T($温度的倒数$\rm )$的变化图正确的是 。
$\rm A$.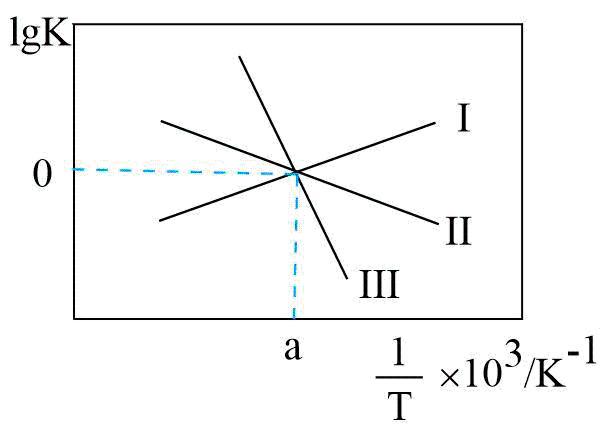
$\rm B$.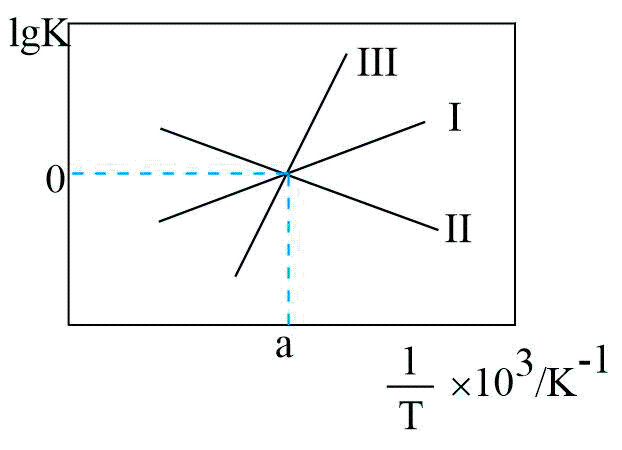
$\rm C$.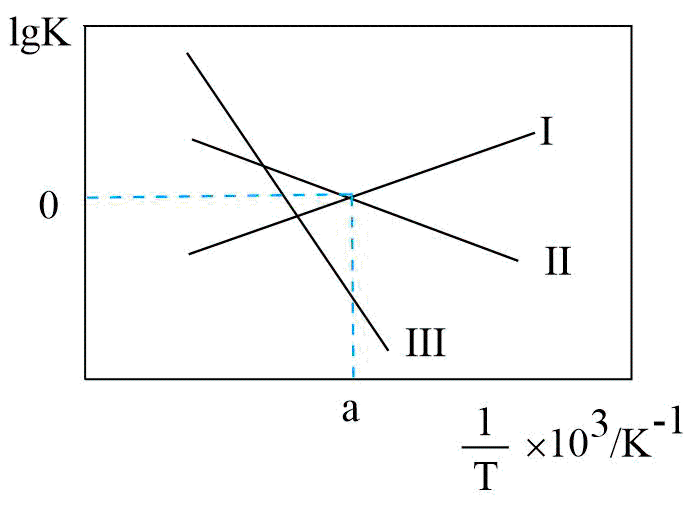
$\rm D$.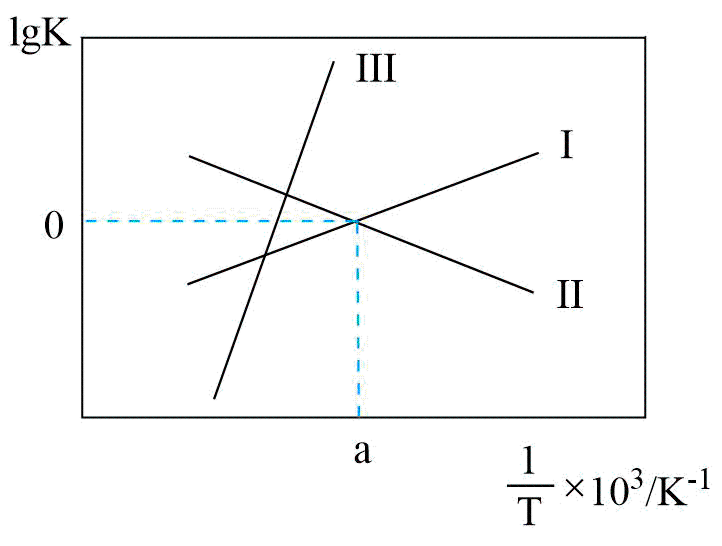
增大;$\\Delta {{H}_{1}}\\lt 0$,$\\Delta {{H}_{2}}\\gt 0$,则Ⅲ反应$\\Delta H=\\Delta {{H}_{1}}-\\Delta {{H}_{2}}\\lt 0$,为放热反应。降温平衡正向移动,所以平衡常数增大;$\\rm B$
"]]①由图可知,应$\rm I$的平衡常数$K$随温度升高而减小,所以为放热反应$\Delta {{H}_{1}}=a\rm \ kJ\cdot mo{{l}^{-1}}\lt 0$;反应Ⅱ的平衡常数$K$随温度升高而增大,所以$\Delta {{H}_{2}}=b\rm \ kJ\cdot mo{{l}^{-1}}\gt 0$;根据盖斯定律Ⅰ$\rm -$Ⅱ得${\rm CO(g)+2{{H}_{2}}(g)\rightleftharpoons C{{H}_{3}}OH(g)}\quad\Delta H=(a-b)\ \rm kJ\cdot mol^{-1}\lt 0$;则降低温度反应$\rm CO(g)+2{{H}_{2}}(g)\rightleftharpoons C{{H}_{3}}OH(g)$的化学平衡常数增大。原因为:$\Delta {{H}_{1}}\lt 0$,$\Delta {{H}_{2}}\gt 0$,则Ⅲ反应$\Delta H=\Delta {{H}_{1}}-\Delta {{H}_{2}}\lt 0$,为放热反应,降温平衡正向移动,所以平衡常数增大。
②反应Ⅲ的平衡常数$K=\dfrac{{{K}_{1}}}{{{K}_{2}}}$,当${{K}_{1}}={{K}_{2}}$时,$\rm K=1$,$\lg K=0$,反应Ⅲ的平衡常数是随温度降低而增大,则关于反应Ⅲ的$\lg K(K$代表化学平衡常数$\rm )$随$1/T($温度的倒数$\rm )$的变化图正确的是$\rm B$。
已知反应Ⅲ的正反应的活化能为$c\rm \ kJ\cdot mo{{l}^{-1}}$,则逆反应的活化能为 $\rm \ kJ\cdot mo{{l}^{-1}}($用含$a$、$b$、$c$代数式表示$\rm )$
$c+b-a$
"]]焓变$\rm =$正反应活化能$\rm -$逆反应活化能,已知反应Ⅲ的正反应的活化能为$c\rm \ kJ\cdot mo{{l}^{-1}}$,则逆反应的活化能为$(c+b-a)\ \rm kJ\cdot mo{{l}^{-1}}$。
温度为$\rm 850\ ^\circ \text{C}$时,反应$\rm CO(g)+{{H}_{2}}O(g)\rightleftharpoons C{{O}_{2}}(g)+{{H}_{2}}(g)$的$K=1$。在固定容积的密闭容器中进行此反应,各物质的浓度$\rm (mol/L)$的变化如下表:
| 时间$\rm (min)$ | $\rm CO$ | $\rm {{H}_{2}}O$ | $\rm C{{O}_{2}}$ | $\rm {{H}_{2}}$ |
| $\rm 0$ | $\rm 0.200$ | $\rm 0.300$ | $\rm 0$ | $\rm 0$ |
| $\rm 2$ | $\rm 0.138$ | $\rm 0.238$ | $\rm 0.062$ | $\rm 0.062$ |
| $\rm 3$ | ${{c}_{1}}$ | ${{c}_{2}}$ | ${{c}_{3}}$ | ${{c}_{3}}$ |
| $\rm 4$ | ${{c}_{1}}$ | ${{c}_{2}}$ | ${{c}_{3}}$ | ${{c}_{3}}$ |
| $\rm 5$ | $\rm 0.116$ | $\rm 0.216$ | $\rm 0.084$ | |
| $\rm 6$ | $\rm 0.096$ | $\rm 0.266$ | $\rm 0.104$ |
①计算:$\rm 3\ min$时$\rm CO$的浓度${{c}_{1}}=$ $\rm \ mol/L$。
②反应在$\rm 4\ min\sim 5\ min$之间数值发生变化,可能的原因是 ,表中$\rm 5\ min\sim 6\ min$之间数值发生变化,可能的原因是 。
$\rm A$.增加水蒸气
$\rm B$.降低温度
$\rm C$.使用催化剂
$\rm D$.增加氢气浓度
$\\rm 0.08$;$\\rm D$;$\\rm A$
"]]①$\rm \begin{matrix} {} &\rm CO(g) & + & \rm {{H}_{2}}O{{(g)}_{{}}} & \rightleftharpoons & \rm C{{O}_{2}}(g) & + & \rm {{H}_{2}}(g) \\ 起始浓度\rm /mol/L & 0.2 & {} & 0.3 & {} & 0 & {} & 0 \\ 变化浓度\rm /mol/L & {{c}_{3}} & {} & {{c}_{3}} & {} & {{c}_{3}} & {} & {{c}_{3}} \\ 平衡浓度\rm /mol/L & 0.2-{{c}_{3}} & {} & 0.3-{{c}_{3}} & {} & {{c}_{3}} & {} & {{c}_{3}} \\ \end{matrix}$由题意知,$\rm 850\ ^\circ \text{C}$时,$K=1.0$,即$K=\dfrac{c{\rm (C{{O}_{2}})}\cdot c{\rm ({{H}_{2}})}}{c{\rm (CO)}\cdot c{\rm ({{H}_{2}}O)}}=\dfrac{{{c}_{3}}\cdot {{c}_{3}}}{(0.2-{{c}_{3}})\cdot (0.3-{{c}_{3}})}=1.0$,解得$c_{3}=0.12\rm \ mol/L$,所以$c_{1}=0.08\rm \ mol/L$。
②由表知,$\rm 3\ min\sim 4\ min$处于平衡状态,通过①计算知此时$\rm CO$、$\rm H_{2}O$、$\rm CO_{2}$和$\rm H_{2}$的浓度分别为$\rm 0.08\ mol/L$、$\rm 0.18\ mol/L$、$\rm 0.12\ mol/L$、$\rm 0.12\ mol/L$,由表中数据可知,$\rm 4\ min\sim 5\ min$时$\rm CO$、$\rm H_{2}O$浓度增大、$\rm CO_{2}$浓度减小,通过$K$计算可得$\rm H_{2}$平衡浓度为$\rm 0.298\ mol/L$,则反应在$\rm 4\ min\sim 5\ min$,平衡向逆方向移动。
$\rm A$.增大水蒸气的浓度,平衡向正反应移动,
$\rm B$.$\rm CO(g)+{{H}_{2}}O(g)\rightleftharpoons C{{O}_{2}}(g)+{{H}_{2}}(g)$为反应Ⅱ的逆反应,其正反应为放热反应,降低温度平衡向正反应移动,
$\rm C$.使用催化剂平衡不移动,
$\rm D$.增大氢气的浓度,平衡向逆反应移动,故$\rm 4\ min\sim 5\ min$改变条件为增大氢气的浓度,故选$\rm D$。
表中$\rm 5\ min\sim 6\ min$之间数值发生变化,温度为$\rm 850^\circ C$下反应在$\rm 5\ min\sim 6\ min$,平衡向正方向移动,可能的原因是增加水蒸气,选$\rm A$。
高中 | 化学平衡常数题目答案及解析(完整版)
