高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
打造宜居环境,消除含氯、氮、硫等化合物的污染对建设美丽家乡具有重要意义。
①以$\rm HCl$为原料,用$\rm {{O}_{2}}$氧化制取$\rm C{{l}_{2}}$,可提高双益,减少污染。反应为:${\rm 4HCl(g)+{{O}_{2}}(g)\rightleftharpoons 2C{{l}_{2}}(g)+2{{H}_{2}}O(g) }\quad\Delta H=-115.4\rm \ kJ\cdot mo{{l}^{-1}}$,通过控制合适条件,分两步循环进行,可使$\rm HCl$转化率接近$\rm 100\%$。原理如图所示:
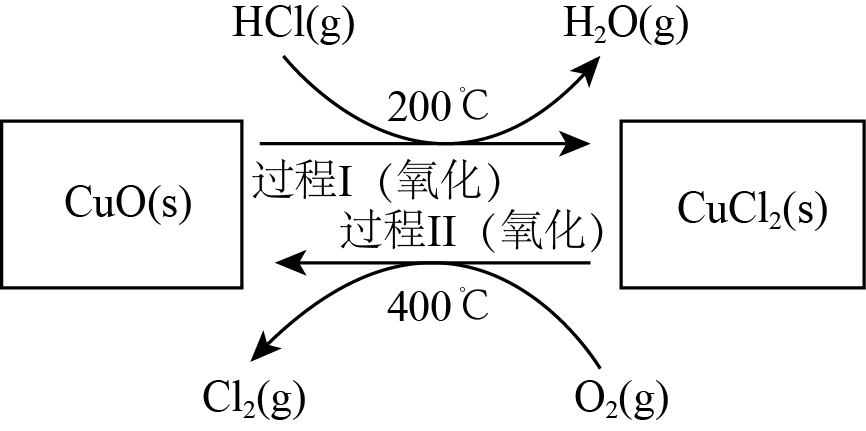
过程Ⅰ的反应为:${\rm 2HCl(g)+CuO(s)\rightleftharpoons CuCl_{2}(s)+{H}_{2} {O}\left({g}\right) }\quad\Delta H_{1}=-120.4\rm \ kJ\cdot mo{{l}^{-1}}$,过程Ⅱ反应的热化学方程式为 。
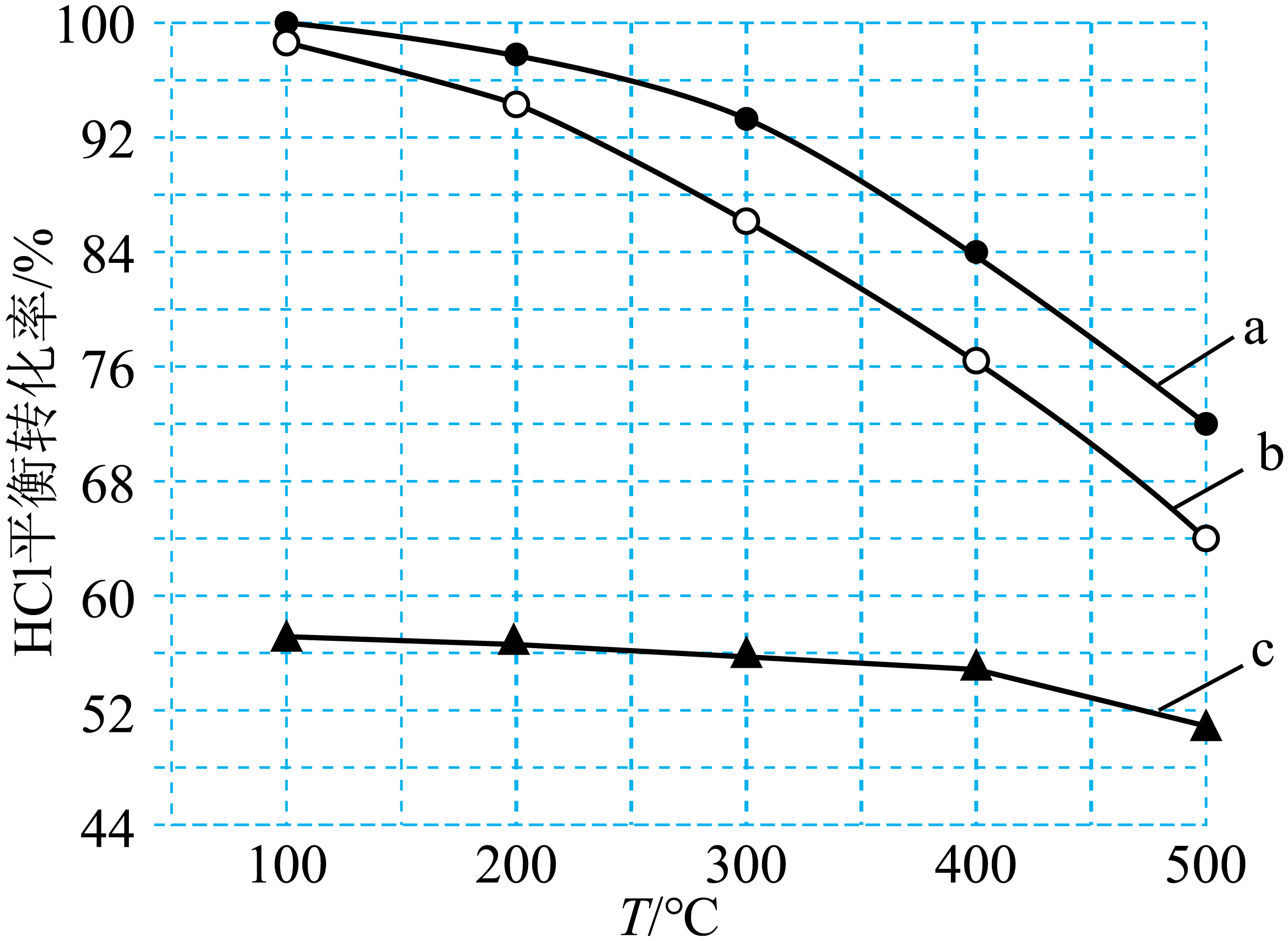
②下图为刚性容器中,进料浓度比$c{\rm (HCl)}:c{\rm ({{O}_{2}})}$分别等于$\rm 1:1$、$\rm 4:1$、$\rm 7:1$时$\rm HCl$平衡转化率随温度变化的关系,进料浓度比$c{\rm (HCl)}:c{\rm ({{O}_{2}})}=1:1$对应图中曲线 $\rm ($填“$\rm a$”、“$\rm b$”或“$\rm c$”$\rm )$。
${\\rm 2CuC{{l}_{2}}(s)+{{O}_{2}}(g)=2CuO(s)+2C{{l}_{2}}(g)}\\quad\\Delta {{H}_{2}}=+125.4\\rm \\ kJ\\cdot mo{{l}^{-1}}$;$\\rm a$
"]]①总反应为:${\rm 4HCl(g)+{{O}_{2}}(g)\rightleftharpoons 2C{{l}_{2}}(g)+2{{H}_{2}}O(g)}\quad \Delta H=-115.4\rm \ kJ\cdot mo{{l}^{-1}}$,过程Ⅰ的反应为:${\rm 2HCl(g)+CuO(s)\rightleftharpoons CuCl_{2}(s)+{H}_{2} {O}\left({g}\right) }\quad\Delta H_{1}=-120.4\rm \ kJ\cdot mo{{l}^{-1}}$,根据盖斯定律,总反应$\rm -2\times $过程Ⅰ的反应得过程Ⅱ反应的热化学方程式为${\rm 2CuC{{l}_{2}}(s)+{{O}_{2}}(g)=2CuO(s)+2C{{l}_{2}}(g)}\quad\Delta {{H}_{2}}=+125.4\rm \ kJ\cdot mo{{l}^{-1}}$。
②刚性容器中,发生$\rm 4HCl(g)+{{O}_{2}}(g)\rightleftharpoons 2C{{l}_{2}}(g)+2{{H}_{2}}O(g)$,进料浓度比$c{\rm (HCl)}:c{\rm (O_{2})}$越大,同温度下$\rm HCl$平衡转化率越小,则据图知,进料浓度比$c{\rm (HCl)}:c{\rm ({{O}_{2}})}=1:1$对应图中曲线为$\rm a$。
研究$\rm CO$还原${\rm N}{\rm O}_{x}$对环境的治理有重要意义,相关的主要化学反应有:
Ⅰ.${\rm N{{O}_{2}}(g)+CO(g)=C{{O}_{2}}(g)+NO(g)}\quad\Delta {{H}_{1}}\lt 0$
Ⅱ.${\rm 2N{{O}_{2}}(g)+4CO(g)\rightleftharpoons {{N}_{2}}(g)+4C{{O}_{2}}(g)}\quad\Delta {{H}_{2}}\lt 0$
Ⅲ.${\rm 2NO(g)+2CO(g)={{N}_{2}}(g)+2C{{O}_{2}}(g)}\quad\Delta H_{3}\lt 0$
①下列描述正确的是 ;$\rm ($填字母序号$\rm )$
$\rm A$.在绝热恒容密闭容器中只进行反应Ⅰ,若压强不变,能说明反应Ⅰ达到平衡状态
$\rm B$.反应Ⅱ$\Delta H\lt 0$,$\Delta S\lt 0$;该反应在低温下自发进行
$\rm C$.恒温条件下,增大$\rm CO$的浓度能使反应Ⅲ的平衡向正向移动,平衡常数增大
$\rm D$.上述反应达到平衡后,升温,三个反应的逆反应速率均一直增大直至达到新的平衡
②一定温度下,向固定体积的密闭容器中充入等物质的量的$\rm NO$和$\rm CO$,体系的初始总压强为$p\ \rm kPa$,发生反应Ⅲ,实验测得,${{v}_{正}}={{k}_{正}}\cdot {{p}^{2}}{\rm (NO)}\cdot {{p}^{2}}\rm (CO)$,${{v}_{逆}}={{k}_{逆}}\cdot p{\rm ({{N}_{2}})}\cdot {{p}^{2}}\rm (C{{O}_{2}})$$({{k}_{正}}$、${{k}_{逆}}$为速率常数,只与温度有关,$p$为物质的分压$\rm )$。达到平衡时,$\rm {{N}_{2}}$占平衡总体积的$\rm 1/4$,则$\dfrac{{{k}_{正}}}{{{k}_{逆}}}=$ $\rm \left({kPa}\right)^{-1}$。
$\\rm AB$;$320/p$
"]]①$\rm A$.密闭容器绝热中只进行反应$\rm I$:${\rm NO_{2}(g)+CO(g)⇌CO_{2}(g)+NO(g)}\quad\Delta H_{1}\lt 0$,反应前后气体系数不变,反应放出热量,体系温度升高,等量气体的压强随之增大,此时压强是变量,若压强不变,能说明温度不再变化,则反应$\rm I$达到平衡状态,故$\rm A$正确。
$\rm B$.由方程式知,反应Ⅱ——${\rm 2NO_{2}(g)+4CO(g)⇌N_{2}(g)+4CO_{2}(g)}\quad\Delta H\lt 0$,$\Delta S\lt 0$,当$\Delta H-T\Delta S\lt 0$时,反应自发进行,该反应在低温下自发进行,故$\rm B$正确。
$\rm C$.恒温条件下,增大$\rm CO$的浓度能使反应Ⅲ——${\rm 2NO(g)+2CO(g)⇌N_{2}(g)+2CO_{2}(g)}\quad\Delta H_{3}\lt 0$的平衡向正向移动,温度不变平衡常数也不变,故$\rm C$错误。
$\rm D$.上述反应正反应均放热,达到平衡后,升温,平衡左移,则三个反应的逆反应速率均先增大后减小直至达到新的平衡,故$\rm D$错误。
②设初始时$\rm NO$和$\rm CO$的物质的量为$a\ \rm mol$,$\rm NO$的转化量为$x$,发生反应Ⅲ——$\rm 2NO(g)+2CO(g)⇌N_{2}(g)+2CO_{2}(g)$,
$\rm \begin{matrix} {} \\ 起始\rm (mol) \\ 转化\rm (mol) \\ 平衡\rm (mol) \\ \end{matrix}\begin{matrix} \rm 2NO(g) \\ a \\ x \\ a-x \\ \end{matrix}\begin{matrix} \rm +2CO(g) \\ a \\ x \\ a-x \\ \end{matrix}\begin{matrix} \rightleftharpoons \rm {{N}_{2}}(g) \\ 0 \\ 0.5x \\ 0.5x \\ \end{matrix}\begin{matrix} \rm +2C{{O}_{2}}(g) \\ 0 \\ x \\ x \\ \end{matrix}$,达到平衡时,$\rm N_{2}$占平衡总体积的$\rm \dfrac{1}{4}$,则$\dfrac{0.5x}{a-x+a-x+\dfrac{x}{2}+x}=\dfrac{1}{4}$,则有$x=0.8a$,反应一定温度下,向固定体积的密闭容器中进行,则$\dfrac{p_{平}}{p_{始}}=\dfrac{1.6a}{2a}=0.8$,${{p}_{平}}=0.8p$,$p{\rm (NO)}=p{\rm (CO)}=\dfrac{1}{8}{{p}_{平}}$,$p{\rm ({{N}_{2}})}=\dfrac{1}{4}{{p}_{平}}p{\rm (C{{O}_{2}})}=\dfrac{1}{2}{{p}_{平}}$,则一定温度下反应Ⅲ平衡时,${{v}_{正}}={{k}_{正}}\cdot {{p}^{2}}{\rm (NO)}\cdot {{p}^{2}}\rm (CO)$,则$\dfrac{{{k}_{正}}}{{{k}_{逆}}}=\dfrac{p{\rm ({{N}_{2}})}{{p}^{2}}\rm (C{{O}_{2}})}{{{p}^{2}}{\rm (NO)}{{p}^{2}}\rm (CO)}=\dfrac{\dfrac{1}{4}{{p}_{平}}\times {{(\dfrac{1}{2}{{p}_{平}})}^{2}}}{{{(\dfrac{1}{8}{{p}_{平}})}^{4}}}=\dfrac{{{(\dfrac{1}{4})}^{2}}}{{{(\dfrac{1}{8})}^{4}}\times 0.8p\ \rm kPa}=\dfrac{320}{p}\ \rm {{(kPa)}^{-1}}$。
将$\rm N{{O}_{2}}$与$\rm S{{O}_{2}}$按体积比$\rm 1:1$充入恒容密闭容器中发生反应:${\rm N{{O}_{2}}(g)+S{{O}_{2}}(g)\rightleftharpoons S{{O}_{3}}(g)+NO(g)}\quad\Delta H\lt 0$,$ {{T}_{1}}\ ^\circ \text{C}$、${{T}_{2}}\ ^\circ \text{C}$时,物质的分压变化如图所示。
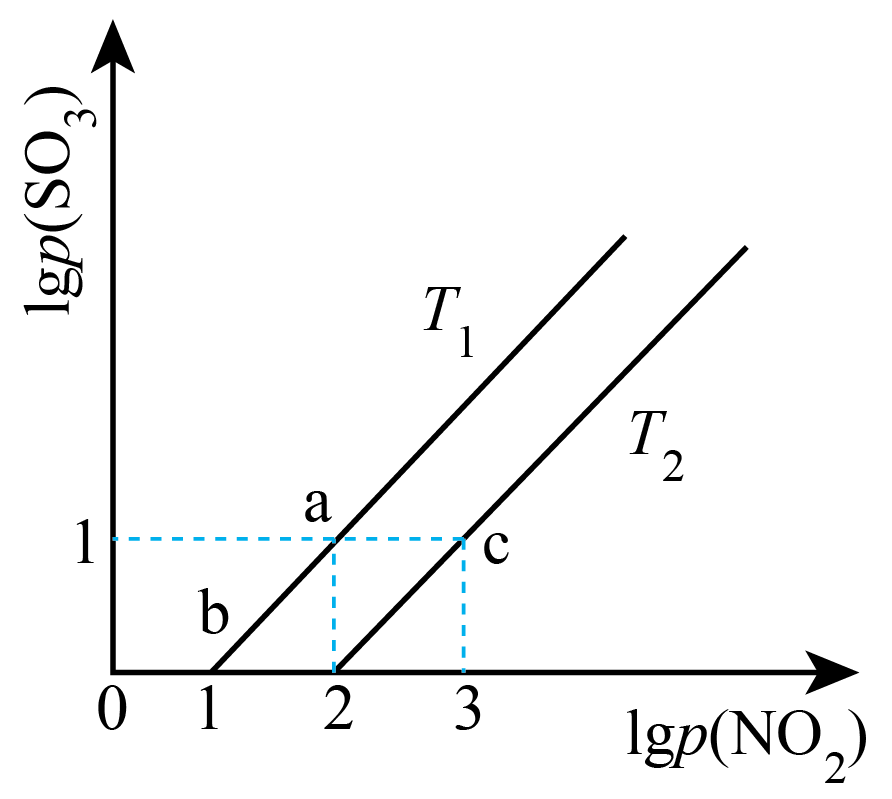
根据题意可知:${{T}_{1}}$ ${{T}_{2}}($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”$\rm )$,由平衡状态$\rm a$到$\rm b$,改变的条件是 。
$\\rm \\lt $;保持温度为${{T}_{1}}$,将容器容积扩大为原来的$\\rm 10$倍
"]]①将$\rm N{{O}_{2}}$与$\rm S{{O}_{2}}$按体积比$\rm 1:1$充入恒容密闭容器中发生反应:${\rm N{{O}_{2}}(g)+S{{O}_{2}}(g)\rightleftharpoons S{{O}_{3}}(g)+NO(g)}\quad\Delta H\lt 0$,若升温则平衡左移、$\rm SO_{3}$浓度降低、$\lg p{\rm (SO_{3})}$减小,则根据题意可知:${{T}_{1}}\lt {{T}_{2}}$。
或结合数据可作定量说明:$T_{1}$对应平衡状态时$\lg p{\rm (NO_{2})}=2$时,$\lg p{\rm (SO_{3})}=1$,此时$p{\rm (NO_{2})}=100$,$p{\rm (SO_{3})}=10$,结合初始时体系中的$\rm N{{O}_{2}}$与$\rm S{{O}_{2}}$按体积比$\rm 1:1$充入恒容密闭容器、$p{\rm (SO_{3})}=p{\rm (NO)}$可知,平衡时$p{\rm (SO_{3})}=p{\rm (NO)}=10$、$p{\rm (NO_{2})}=p{\rm (SO_{2})}=100$,此时平衡常数$K_{\rm p1}=\dfrac{10\times 10}{100\times 100}=0.01$;同理$T_{2}$对应平衡状态时$\lg p{\rm (NO_{2})}=3$时,$\lg p{\rm (SO_{3})}=1$,此时平衡时$p{\rm (SO_{3})}=p{\rm (NO)}=10$、$p{\rm (NO_{2})}=p{\rm (SO_{2})}=1000$,此时平衡常数$K_{\rm p2}=\dfrac{10\times 10}{1000\times 1000}=0.0001\lt K_{\rm p1}$;又该反应$\Delta H\lt 0$,温度升高平衡逆向移动,$K$减小,则$T_{2}$对应温度较高。
②由图可知$\rm a$到$\rm b$过程中反应物和生成物的浓度等倍减小,则应为扩大容器体积即减小压强导致;由平衡状态$\rm a$到$\rm b$,横坐标和纵坐标均减小$\rm 1$个单位,则改变的条件是保持温度为${{T}_{1}}$,将容器容积扩大为原来的$\rm 10$倍。
高中 | 化学平衡常数题目答案及解析(完整版)
