高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
习近平主席在第$\rm 75$届联合国大会提出:“我国要实现“$\rm 2030$年碳达峰、$\rm 2060$年碳中和的目标”。因此$\text{C}{{\text{O}}_{2}}$的捕获利用与封存成为科学家研究的重要课题。$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$和$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)$的干法重整$\rm (DRM)$反应可同时转化两种温室气体,并制备$\text{CO}$和${{\text{H}}_{2}}$。主要反应如下:
反应Ⅰ:$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)+\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons 2\text{CO}\left( \text{g} \right)+2{{\text{H}}_{2}}\left( \text{g} \right)\quad \Delta {{H}_{1}}$;
反应Ⅱ:$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)+3\text{C}{{\text{O}}_{2}}\left( \text{g} \right)\rightleftharpoons 4\text{CO}\left( \text{g} \right)+2{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\quad \Delta {{H}_{2}}$;
反应Ⅲ:$\text{CO}\left( \text{g} \right)+{{\text{H}}_{2}}\text{O}\left( \text{g} \right)\rightleftharpoons \text{C}{{\text{O}}_{2}}\left( \text{g} \right)+{{\text{H}}_{2}}\left( \text{g} \right)\quad \Delta {{H}_{3}}\rm ;$
已知:反应Ⅰ、Ⅱ的自发均需高温条件。
上述三个反应的平衡常数${{K}_{\text{p}}}、\Delta H$与温度$\rm T$关系如图所示。图中$\rm a$点代表的是 $\rm ($填“Ⅰ”“Ⅱ”或“Ⅲ”$\rm )$反应的$\Delta H$,$\Delta {{H}_{3}}=$ $\;\rm \text{kJ}\cdot \text{mo}{{\text{l}}^{-1}}$。
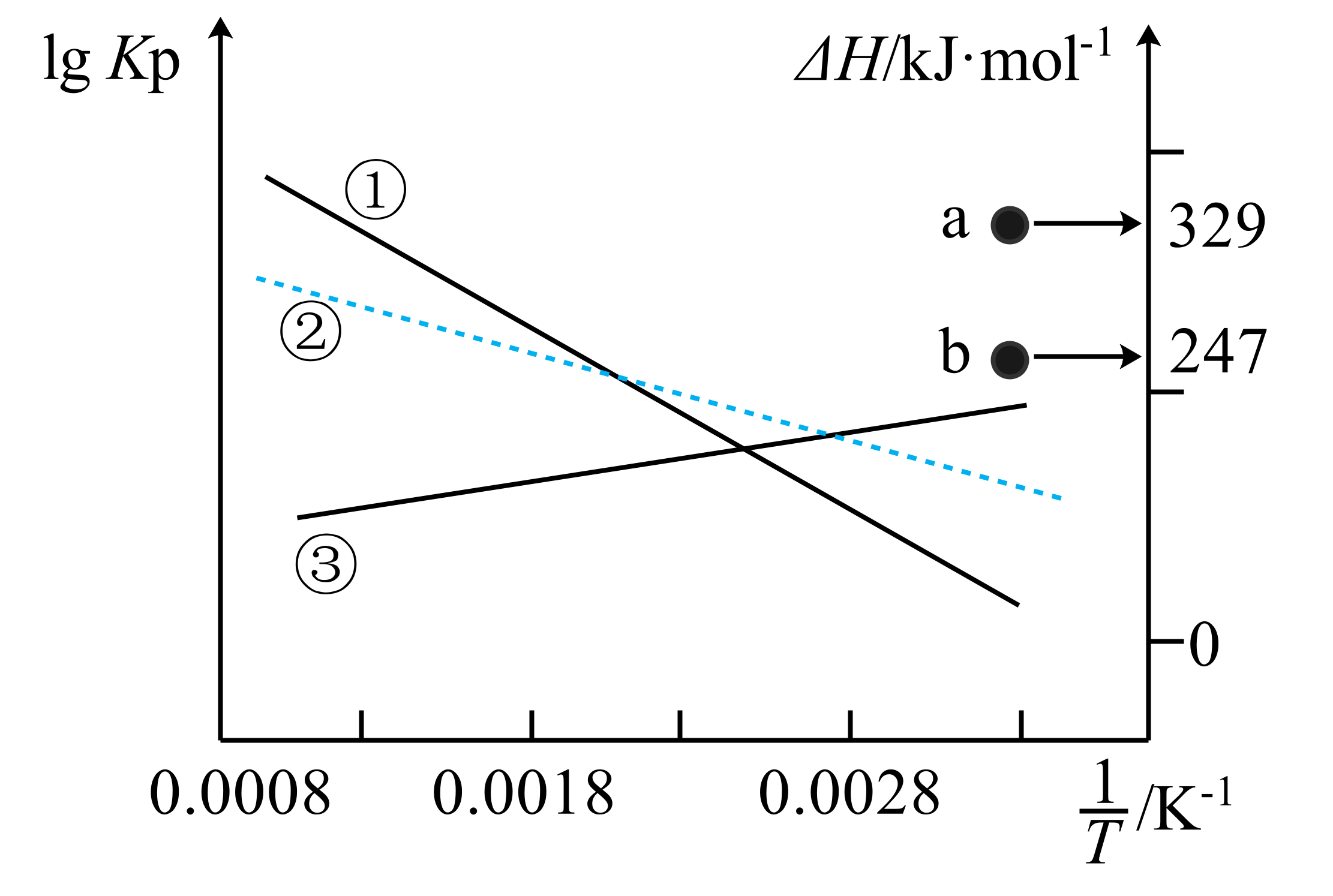
Ⅱ ; $\\rm -41$
"]]已知:反应Ⅰ、Ⅱ的自发均需高温条件;反应Ⅰ、Ⅱ均为熵增的反应,由于自发均需高温条件,则两者的焓变为正值,是吸热反应;升高温度反应Ⅰ、Ⅱ平衡正向移动,平衡常数增大,则对应曲线为①②中的一条曲线,则③为反应Ⅲ曲线,其为放热反应,焓变小于零;反应Ⅱ$\rm =$Ⅰ$\rm -2\times $Ⅲ,则$\Delta {{H}_{2}}=\Delta {{H}_{1}}-2\Delta {{H}_{3}}$,故$\Delta {{H}_{2}}$的值更大,故图中$\rm a$点代表的是Ⅱ反应的$\Delta H$,$\Delta {{H}_{3}}=\dfrac{\Delta {{H}_{1}}-\Delta {{H}_{2}}}{2}=\dfrac{247-329}{2}\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}=-41\text{ kJ}\cdot \text{mo}{{\text{l}}^{-1}}$;
将原料按$n\left( \text{C}{{\text{H}}_{4}} \right):n\left( \text{C}{{\text{O}}_{2}} \right)=1:1$充入密闭容器中发生反应Ⅰ,保持体系压强为$100\text{ kPa}$发生反应,达到平衡时$\text{C}{{\text{O}}_{2}}$体积分数与温度的关系$\rm ($图中黑线$\rm )$如图所示:
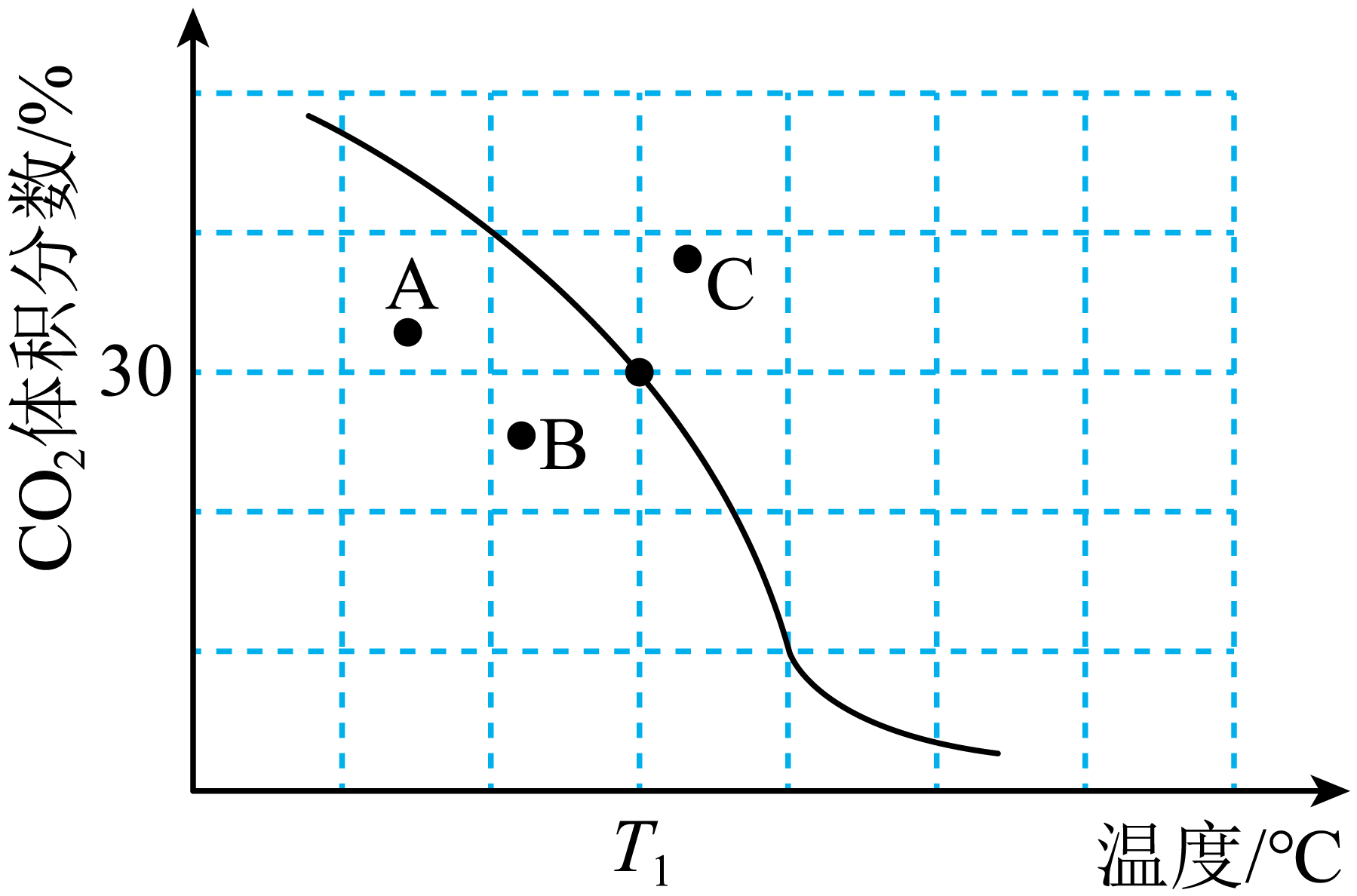
①${{T}_{1}}\ {}^\circ \text{C}$,$\rm 100$ $\rm kPa$下,平衡时容器体积与初始容器体积之比为 ;该温度下,此反应的平衡常数${{K}_{\text{p}}}=$ ${{(\text{kPa})}^{2}}\rm ($用平衡分压代替平衡浓度计算,分压$\rm =$总压$\times $物质的量分数$\rm )$。
②若$\rm A$、$\rm B$、$\rm C$三点表示不同温度和压强下已达平衡时$\text{C}{{\text{O}}_{2}}$的体积分数, 点对应的平衡常数最小, 点对应的压强最大。
$\\rm 4:5$ ; $\\dfrac{1600}{9}$ ; $\\rm A$ ; $\\rm C$
"]]①${{T}_{1}}\ {}^\circ \text{C}$,$\rm 100$ $\rm kPa$下,设初始甲烷、二氧化碳投料均为$\rm 1$ $\rm mol$,平衡时二氧化碳的体积分数为$\rm 30\%$;
$\begin{matrix} {} \\ 起始\left( \text{mol} \right) \\转化\left( \text{mol} \right) \\平衡 \left( \text{mol} \right) \\ \end{matrix}\begin{matrix} \text{C}{{\text{H}}_{\text{4}}}\text{(g)} \\ \text{1} \\ a \\ 1-a \\ \end{matrix}\begin{matrix} + \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} \text{C}{{\text{O}}_{\text{2}}}\text{(g)} \\ \text{1} \\ a \\ 1-a \\ \end{matrix}\begin{matrix} \rightleftharpoons \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} \text{2CO(g)} \\ \text{0} \\ 2a \\ 2a \\ \end{matrix}\begin{matrix} + \\ {} \\ {} \\ {} \\ \end{matrix}\begin{matrix} \text{2}{{\text{H}}_{\text{2}}}\text{(g)} \\ \text{0} \\ 2a \\ 2a \\ \end{matrix}$
则$\dfrac{1-a}{2+2a}\times 100\%=30\%$,$a=0.25\text{ mol}$;总的物质的量为$\rm 2.5$ $\rm mol$,同温同压,体积之比等于物质的量之比,容器体积与初始容器体积之比为$\rm 2:2.5=4:5$;该温度下,此反应的平衡常数$K_{\text{p}}^{{}}=\dfrac{{{\left( \text{100 kPa}\times \dfrac{0.5}{2.5} \right)}^{\text{2}}}{{\left( \text{100 kPa}\times \dfrac{0.5}{2.5} \right)}^{\text{2}}}}{\text{100 kPa}\times \dfrac{0.75}{2.5}\times \text{100 kPa}\times \dfrac{0.75}{2.5}}=\dfrac{1600}{9}{{(\text{kPa})}^{2}}$;
②若$\rm A$、$\rm B$、$\rm C$三点表示不同温度和压强下已达平衡时$\rm CO_{2}$的体积分数,由于平衡常数仅仅是温度的函数,且该反应正反应是一个吸热反应,升高温度平衡正向移动,平衡常数增大,$\rm A$点对应的平衡常数最小;该反应增大压强平衡逆向移动,$\rm CO_{2}$的体积分数增大,故$\rm C$点对应$\rm CO_{2}$的体积分数大,温度高,压强最大。
在其他条件相同,不同催化剂$\rm (A$、$\rm B)$作用下,使原料$\text{C}{{\text{O}}_{2}}\left( \text{g} \right)$和$\text{C}{{\text{H}}_{4}}\left( \text{g} \right)$发生反应Ⅰ反应相同的时间,$\text{CO}\left( \text{g} \right)$的产率随反应温度的变化如图:
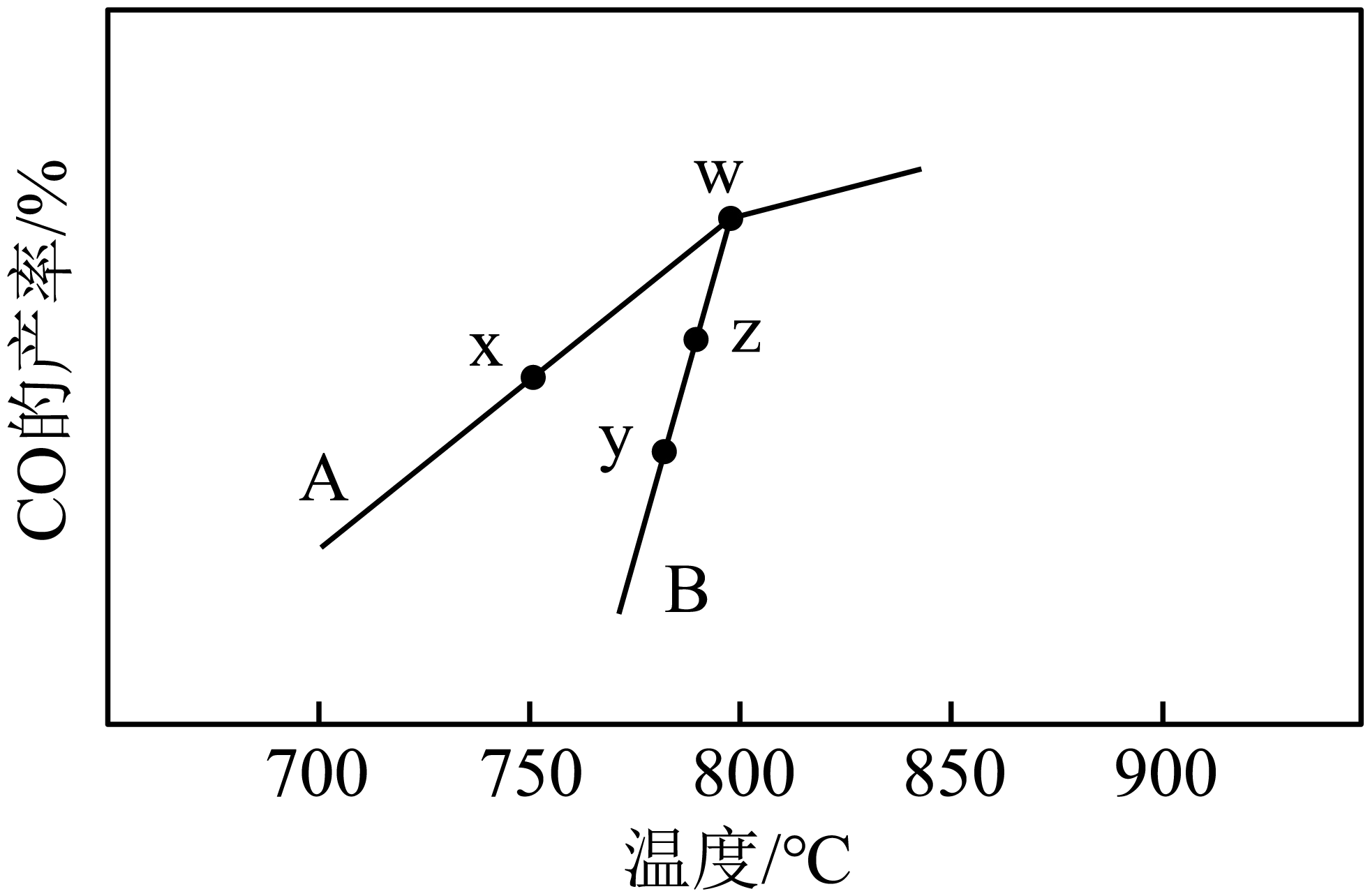
①在催化剂$\rm A$、$\rm B$作用下,它们正、逆反应活化能差值分别用$\Delta{{E}_{\text{a}}}\left( \text{A} \right)$和$\Delta{{E}_{\text{a}}}\left( \text{B} \right)$表示,则$\Delta{{E}_{\text{a}}}\left( \text{A} \right)$ $\Delta{{E}_{\text{a}}}\left( \text{B} \right)\rm ($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”$\rm )$。
②$\rm y$点对应的逆反应速率$v\rm ($逆$\rm )$ $\rm z$点对应的正反应速率$v\rm ($正$\rm )($填“$\rm \gt $”“$\rm \lt $”或“$\rm =$”$\rm )$
$\\rm =$ ; $\\rm \\lt $
"]]①在催化剂$\rm A$、$\rm B$作用下,它们正、逆反应活化能差值即该反应的反应热,催化剂影响反应速率但不影响反应的焓变,分别用$E\left( \text{A} \right)$、$E\left( \text{B} \right)$表示,则$E\left( \text{A} \right)=E\left( \text{B} \right)$;
②由图可知,$\rm y$点对应的温度低于$\rm z$点对应的温度,温度越高反应速率越快,故$\rm y$点对应的$v\rm ($逆$\rm )\lt z$点对应的$v\rm ($正$\rm )$。
高中 | 化学平衡常数题目答案及解析(完整版)
