高中 | 化学平衡常数 题目答案及解析
稿件来源:高途
高中 | 化学平衡常数题目答案及解析如下,仅供参考!
选修四
第二章 化学反应速率和化学平衡
第三节 化学平衡
化学平衡常数
苯乙烯是一种很重要的有机化学原料,用途十分广泛。乙苯催化脱氢可生成苯乙烯。反应如下:
![]() $\Delta H=+123.5\rm \ kJ\cdot mo{{l}^{-1}}$。
$\Delta H=+123.5\rm \ kJ\cdot mo{{l}^{-1}}$。
在体积为$\rm 2\ L$的恒温密闭容器中通入$\rm 2\ mol$乙苯蒸气,$\rm 2\ min$后达到平衡,测得氢气的浓度是$\rm 0.5\ mol\cdot {{L}^{-1}}$。
①用乙苯表示该反应的反应速率为 。
②保持温度和容器体积不变,向上述平衡体系中再通入$\rm 1.5\ mol$氢气和$\rm 1.5\ mol$乙苯蒸气,则${{v}_{正}}$ ${{v}_{逆}}($填“大于”、“小于”或“等于”)。
$\\rm 0.25\\ mol\\cdot L^{-1}\\cdot min^{-1}$;等于
"]]①反应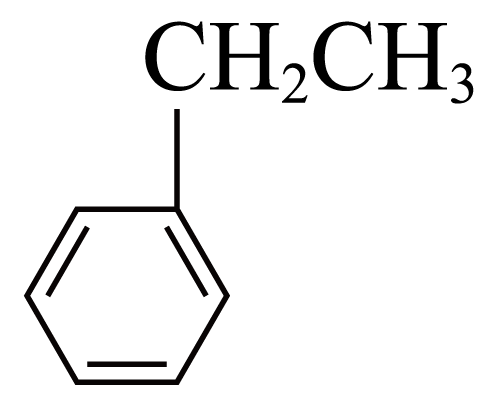 $\rm (g)\overset{催化剂}{\underset{}{\rightleftharpoons}}$
$\rm (g)\overset{催化剂}{\underset{}{\rightleftharpoons}}$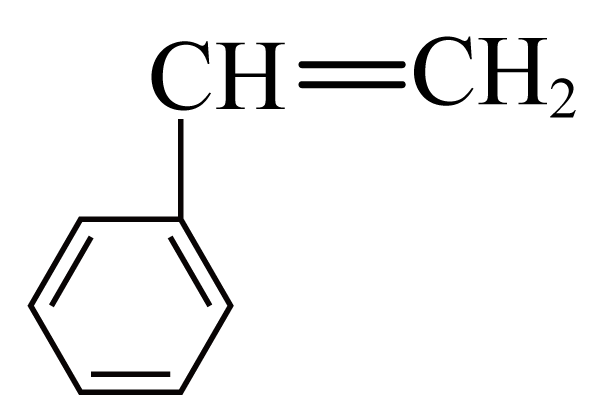 $\rm (g)+H_{2}(g)$,达到平衡时,氢气的浓度是$\rm 0.5\ mol\cdot {{L}^{-1}}$,则
$\rm (g)+H_{2}(g)$,达到平衡时,氢气的浓度是$\rm 0.5\ mol\cdot {{L}^{-1}}$,则 也为$\rm 0.5\ mol\cdot {{L}^{-1}}$,
也为$\rm 0.5\ mol\cdot {{L}^{-1}}$, 为$\rm 1\ mol\cdot {{L}^{-1}}-0.5\ mol\cdot {{L}^{-1}}=0.5\ mol\cdot {{L}^{-1}}$,乙苯蒸汽的反应速率为:$\rm \dfrac{0.5\ mol/L}{2\ min}=0.25\ mol\cdot {{L}^{-1}}\cdot mi{{n}^{-1}}$。
为$\rm 1\ mol\cdot {{L}^{-1}}-0.5\ mol\cdot {{L}^{-1}}=0.5\ mol\cdot {{L}^{-1}}$,乙苯蒸汽的反应速率为:$\rm \dfrac{0.5\ mol/L}{2\ min}=0.25\ mol\cdot {{L}^{-1}}\cdot mi{{n}^{-1}}$。
②根据分析可知,$K=\dfrac{0.5\times 0.5}{0.5}=0.5$,维持温度和容器体积不变,向上述平衡中再通入$\rm 1.5\ mol$氢气和$\rm 1.5\ mol$乙苯蒸汽,${{Q}_{\rm c}}={\rm \dfrac{(0.5\ mol/L+\dfrac{1.5\ mol}{2\ L})\times 0.5\ mol/L}{0.5\ mol/L+\dfrac{1.5\ mol}{2\ L}}}=0.5=K$,平衡不移动,则$v_{正}$等于$v_{逆}$。
为提高乙苯的平衡转化率,可采取的措施有 、 。
升高温度;降低压强
"]]该反应为是吸热反应,且是气体体积增大的反应,要提高乙苯的平衡转化率,即平衡正向移动,因此可采取的措施有:升高温度、降低压强。
实际生产时该反应在恒压条件下进行,且向乙苯蒸气中掺入水蒸气,利用热力学数据计算得到温度和投料比($y$)对乙苯的平衡转化率的影响如图所示。$\left[ y=\dfrac{n\rm ({{H}_{2}}O)}{n{(乙苯)}} \right]$
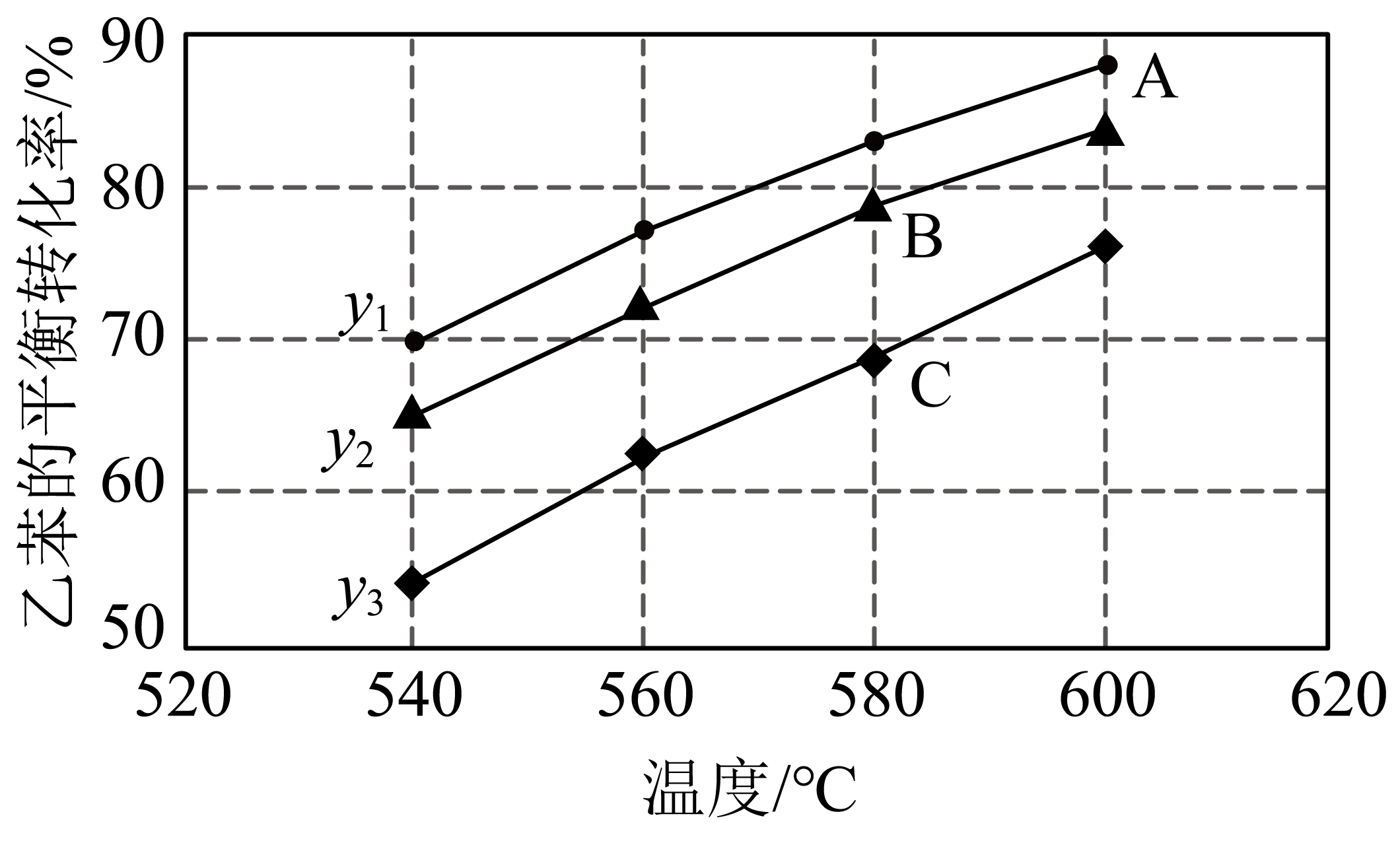
①图中投料比$({{y}_{1}},{{y}_{2}},{{y}_{3}})$的大小顺序为 ,理由是 ,
②图中A、B、C三点对应平衡常数大小顺序为 (用${{K}_{\rm A}}$、${{K}_{\rm B}}$、${{K}_{\rm C}}$表示)。
③向乙苯中掺入水蒸气,可防止催化剂表面产生积碳,消除积碳的化学方程式为 。
${{y}_{1}}\\gt {{y}_{2}}\\gt {{y}_{3}}$;该反应是气体分子数增大的反应,恒压条件下,充入水蒸气,相当于减压,扩大容器体积,平衡正向移动程度增大,乙苯平衡转化率增大;${{K}_{\\rm A}}\\gt {{K}_{\\rm B}}={{K}_{\\rm C}}$;$\\rm C+{{H}_{2}}O(g)\\begin{matrix} \\underline{\\underline{高温}} \\\\ {} \\\\ \\end{matrix}CO+{{H}_{2}}$
"]]①反应在恒压条件下进行,$y=\dfrac{n\rm ({{H}_{2}}O)}{n{(乙苯)}}$,可看作是充入的乙苯不变,增加充入水蒸气的量,相当于减压,扩大容器体积,而该反应正向气体分子数增大,减小压强平衡正向移动,提高可乙苯的转化率,因此乙苯的平衡转化率大,对应的$y$即投料比大,即${{y}_{1}}\gt {{y}_{2}}\gt {{y}_{3}}$
②由图象可知,温度升高苯乙烯的转化率增大,则升温时平衡正反应方向移动,正反应方向为吸热反应,升温$K$增大,且$K$只受温度影响,温度不变,$K$不变,因此A、B、C三点对应平衡常数大小顺序为${{K}_{\rm A}}\gt {{K}_{\rm B}}={{K}_{\rm C}}$。
③恒压条件下,向乙苯中掺入水蒸气,其原因:防止催化剂表面产生积碳,利用碳和水蒸气反应生成$\rm CO$和氢气,其化学方程式为$\rm C+{{H}_{2}}O(g)\begin{matrix} \underline{\underline{高温}} \\ {} \\ \end{matrix}CO+{{H}_{2}}$;总压不变,加入水蒸气,乙苯分压减小,$Q_{\rm p}$小于$K_{\rm p}$,平衡正向移动,乙苯的平衡转化率增大。
高中 | 化学平衡常数题目答案及解析(完整版)
